来源:富途
受牛津大学的ChAdOx1 nCoV-19 疫苗在动物实验失败影响,近期康希诺生物股票价格直接下跌近30%。在5月22日晚间,中国陈薇团队研发的重组腺病毒5 型载体新冠疫苗(Ad5-nCoV)的I 期试验结果在国际学术期刊《柳叶刀》在线发表,疫苗显示出安全耐受性及免疫反应性,整体结果令人满意,后期临床打下良好基础。但是,康希诺生物的股票价格依然下跌,这是为什么呢?是大家对疫苗的数据失去了信仰?
本文会重点分析康希诺腺病毒疫苗和牛津腺病毒疫苗的区别,也同时会对康希诺的I期实验结果重点解读。
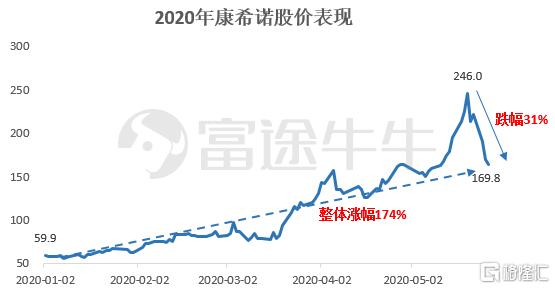
数据来源:wind,富途证券整理
5 月13 日,牛津大学Sarah C. Gilbert 教授实验室发表ChAdOx1 nCoV-19 疫苗在动物模型身上实验结果的预印版,结果显示小鼠和恒河猴接种疫苗后都产生了体液免疫和细胞免疫反应。恒河猴实验中,接种疫苗能显著减少气管肺泡灌洗液和呼吸道组织中病毒载量,并且无肺部炎症及免疫增强效应发生。
5 月21 日,来自商业杂志《Business Standard》一篇报道,认为牛津大学候选疫苗在动物实验中失败。为什么同一组数据,得到两组不一样的结论呢?到底谁是真的,谁是假的?
一、有效疫苗标准:
为了证明什么样得疫苗是有效的?我们先得知道疫苗研发成功的核心标准是什么?
1)通过激活免疫反应彻底杀灭病毒是评价疫苗的黄金标准;
2)在病毒抗体滴度上,一般一款有效的疫苗产生的中和抗体稀释超过1000 倍后仍保持活性;
根据以上的两个标准,那么牛津大学的Sarah C. Gilbert 教授实验室发表ChAdOx1 nCoV-19 疫苗复合标准了吗?
首先,牛津大学的Sarah C. Gilbert 教授实验室ChAdOx1 nCoV-19疫苗只是显著减少气管肺泡灌洗液和呼吸道组织中病毒载量,部分接种疫苗的动物与未接种的动物都能在支气管检测到病毒RNA,但接种了疫苗的动物肺部炎症比未接种的弱。简单点理解就是,注射该疫苗对人体可能是有效的,但不能起到彻底杀死病毒作用,依然可以在肺部检测到新冠病毒,但比没有接种该疫苗检测到的病毒少;
其次,实验中动物血清仅稀释4-40 倍便失活,与被稀释1000倍的标准仍保持活性的差距太大了;
二、牛津腺病毒疫苗在人体的作用机理
COVID-19 易激起Th1 型免疫反应(辅助T细胞反应),导致肺部炎症等症状。那么接种牛津腺病毒疫苗(可以简单理解成,该疫苗是没有毒性的COVID-19病毒,按道理来说在人体不致病)也同样是引起Th1 型免疫反应。按理论来说,牛津腺病毒应该减少炎症因子产生,防止肺炎。

图片来源:中国农业大学
可惜的是,牛津腺病毒疫苗的结果不符合成为我们疫苗的标准:
1)接种该疫苗之后,依然可以在恒河猴动物体内检测新冠肺炎;
2)实验中动物血清仅稀释4-40 倍便失活;
三、牛津腺病毒疫苗与康希诺腺病毒疫苗差异
1)相同点:
牛津腺病毒疫苗和康希诺腺病毒疫苗两者均是选取全长S 蛋白作为疫苗相同(如下图)。灭活疫苗是全病毒衣壳蛋白,也产生了较高滴度的S 蛋白和RBD 蛋白的中和抗体。所以说,他们两款的腺病毒的作用机理是一样的,带有目标蛋白基因的腺病毒通过自身的感染机制侵入细胞,激起免疫反应。
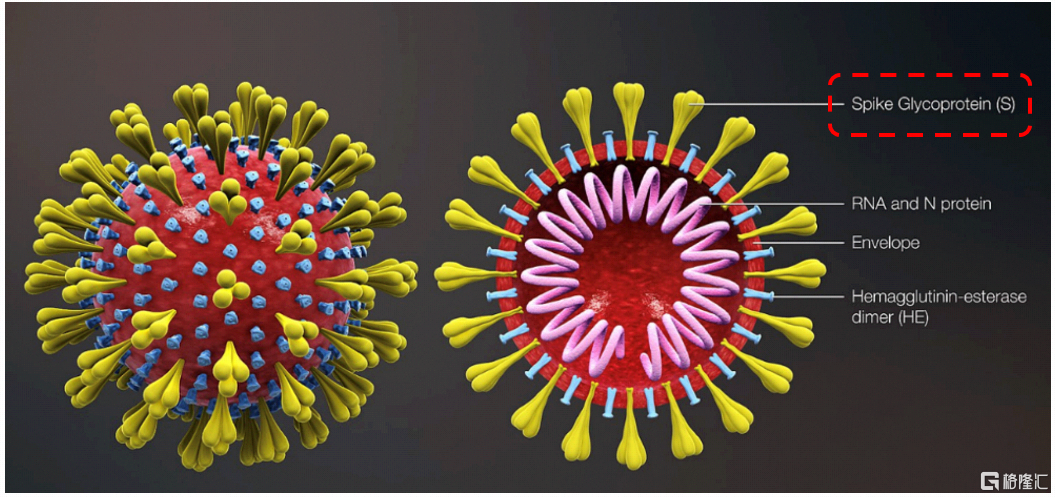
2)不同点:
牛津大学腺病毒疫苗载体来自非灵长类的黑猩猩,人体预存免疫较小。而康希诺Ad5 型腺病毒人体预存免疫较大,因此需要公司通过对腺病毒载体进行修饰以降低预存免疫。人们普遍对腺病毒已经产生了抗体,所以腺病毒载体对大多数人不致命,相对安全。
注:腺病毒,通常是毒性弱,普遍引起大家小感冒的的一种病毒。
康希诺腺病毒疫苗最新临床结果
5 月22 日晚间,中国陈薇团队研发的重组腺病毒5 型载体新冠疫苗(Ad5-nCoV)的I 期试验结果在国际学术期刊《柳叶刀》在线发表,结果显示疫苗的耐受性,也显示出免疫反应性,数据为后续的研究和后期临床打下良好基础。
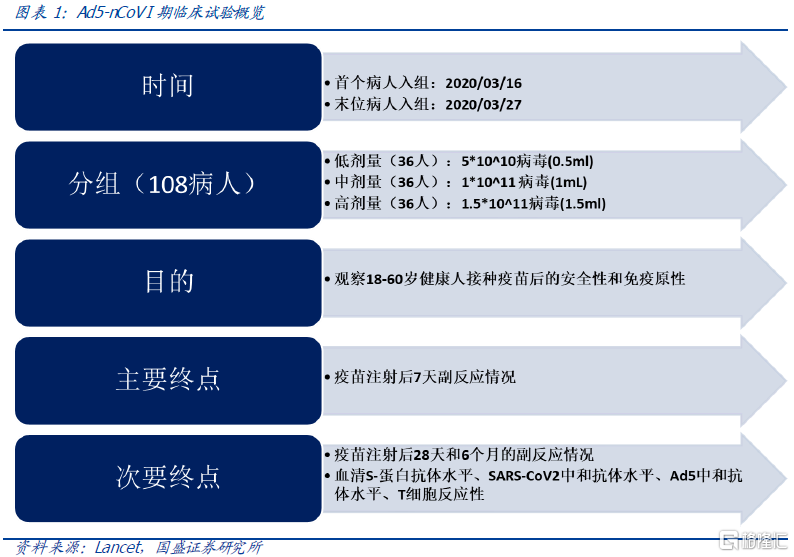
1)实验设计:
根据年龄、性别共108名健康人士参与低、中、高三个剂量组疫苗注射实验。目的是观察18-60岁健康人接种疫苗后的安全性和免疫原性。
2)I期实验结论:
a)康希诺的Ad5-nCoV 疫苗接种后28 日可耐受并具免疫原性;
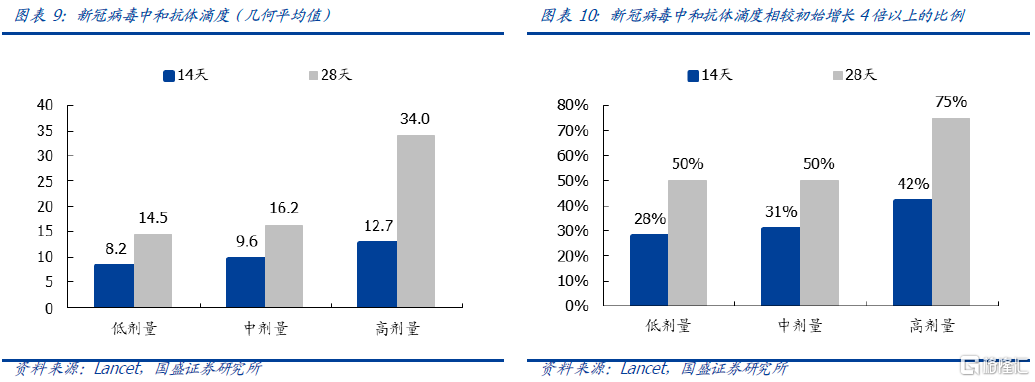
b)接种后的第28 日体液免疫达到峰值。接种疫苗后产生的抗体是否如愿针对S 蛋白是非常重要的。本次试验中注射疫苗后14 天即显示了针对S 蛋白的免疫应答,28 天的时候各个剂量组4 倍抗体滴度的比例都达到90%以上,高剂量组100%出现4 倍抗体滴度。根据绝对指标理论来看,至少要达到1000左右才算高,本实验中的高剂量组平均滴度达1445.8,远高于1000的标准。
c)特异性T 细胞应答在接种后第14 天达到峰值。接种后第14 和28 天各个剂量组都从CD4+(被激活的细胞毒性T细胞和巨噬细胞的激活)及CD8+ T 细胞(细胞毒性T细胞)检测到INFγ(细胞因子)。简单来说,就是康希诺腺病毒疫苗在人体有效,能够激起人体的免疫系统来杀死新冠病毒,不出现新冠肺炎。

I期的实验结果总体达到实验设计目的,初步结果支持Ad5-nCoV 疫苗的进一步研究。
3)副作用:
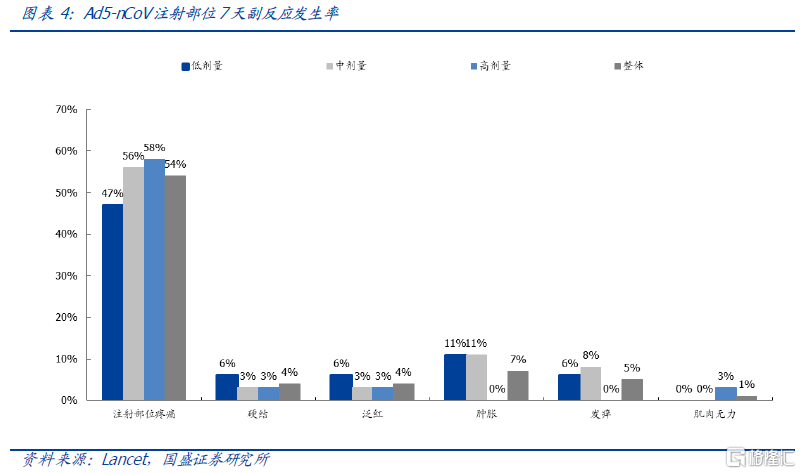
安全性结果:不良反应以轻中度为主,接种后28 天内未发现严重不良事件,中低剂量组耐受性较好。
(注:我们对药物中不追求100%的安全,因为这样子付出的生命成本太大了,况且这个世界基本上没有绝对安全的药物,是药三分毒。打个比如,很多晚期癌症患者他们根本不需要100%的安全的药物,而是能用上相对安全有效药物,对于他们来说目前能够延长现在的生命是最重要的。因为开发出100%安全有效的药物可能需要30-50年时间或更长时间,为了减少失去一个生命的代价,当前有可能需要牺牲10个患者,因为患者更多是在与时间赛跑的,等不起。)
3 级不良发生情况:高剂量组发生率高,但整体3级不良反应发生率可控。低剂量组和中剂量组7 天和28 天3 级不良反应发生率均为6%,高剂量组为17%。三级不良反应主要在高剂量组,不良反应包括严重发烧、严重疲劳、严重肌肉疼痛和严重呼吸障碍。整体3 级不良反应发生率可控。
4)后续临床实验:
康希诺已于4月12日启动了二期临床试验,成为当时全球唯一进入二期临床试验的新冠病毒疫苗。临床II 期是确定免疫程序和免疫剂量,通过考察人群中总体获得最高抗体滴度的实验组以及综合对比其他指标来确定最优剂量。之后将这个剂量应用于临床III 期,也就是在更大范围内接种并评估副作用,需要至少上万名志愿者。
由于国内缺乏新增病例,预计陈薇团队的III 期试验计划在国外进行。康希诺生物公告显示,2020 年5 月15 日获得加拿大卫生部关于重组疫苗(腺病毒载体)「Ad5-nCoV」临床试验申请批准。但具体的III 期临床以何种方式开展还要看II 期临床的结果。
其他疫苗:
1)Moderna:
国外目前进度最快的是Moderna 的mRNA-1273的I 期结果数据不完整的,争议较大,数据质量远低于康希诺腺病毒疫苗数据。Moderna只公布最初的 8 位受试者中(25 ug 和 100 ug 剂量组各前四位),产生中和抗体,可有效阻止病毒感染细胞,剩余37 人结果并未公布。另外,公司公告说患者产生的抗体水平跟自然感染的康复患者差不多甚至更高,但未公布抗体水平。
2)牛津腺病毒疫苗:
牛津腺病毒疫苗在恒河猴实验中,接种疫苗能显著减少气管肺泡灌洗液和呼吸道组织中病毒载量,并且无肺部炎症及免疫增强效应发生。好的结果是其中3 只猴子虽然有呼吸急促的问题,但并没有明显的肺部损害,所以该疫苗可能会减小病毒的伤害,但并不能防止出现肺炎。
3)全球其他新冠疫苗进程:
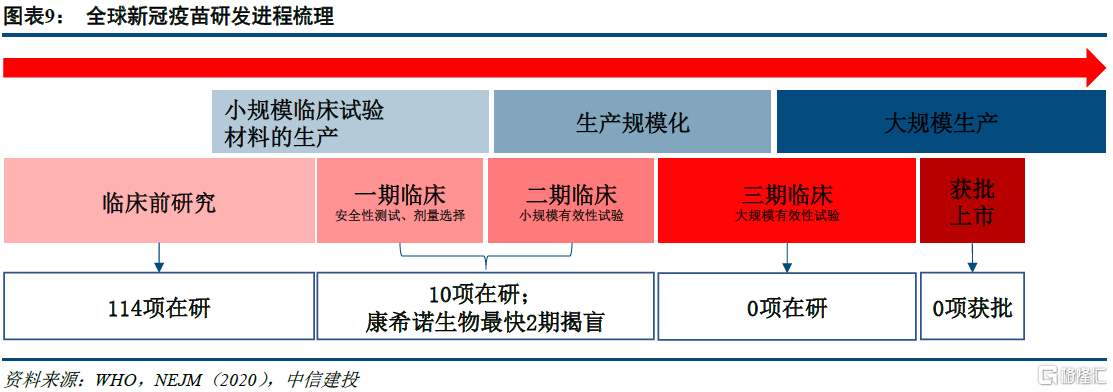
根据WHO 数据,截至2020 年5 月22 日,全球范围内共计124 项新冠疫苗研发项目正在同步推进,其中10 款新冠疫苗进入临床研究阶段,其余114 项新冠疫苗项目仍处于临床前研究阶段。我国康希诺生物研发的腺病毒载体新冠疫苗I期实验结果整体有效,率先进入2 期临床研究,有望6 月揭盲,未来有望在海外进行更大范围的III期临床实验。
总结:
近期,牛津腺病毒疫苗的动物实验能显著减少气管肺泡灌洗液和呼吸道组织中病毒载量,但在人体无免疫增强效应发生,所以整体来说牛津腺病毒疫苗的研发是失败的,不符合成为疫苗的标准。正是因为康希诺的腺病毒疫苗与牛津腺病毒的作用机理是一样的,所以造成大家对康希诺腺病毒的质疑。在5月22日晚间,康希诺生物对外发布其I期疫苗显示出安全耐受性及免疫反应性,整体结果令人满意等公告,依然无法缓解大家近期对疫苗质疑的态度。
市场对新药的估值体系通常有两种思维。第一种,全球还未存在的新款药物,且是迫切药物,那么最大的赢家有可能是最快能获批上市的药物。第二种估值体系,市场上已经有2-3种同款的药物,那么最大的赢家是谁呢?可能是同类最优的、也可能是价格最低的,在中国则是能够进入国家医保目录的药物。显然,我们现在对于康希诺生物的估值更应该是第一种(假设定价100元/次注射,则中国保守市场收入估计可能为100*1亿人口=100亿元)。
根据WHO 数据,目前全球范围内共计124 项新冠疫苗研发项目正在同步推进,我国康希诺生物研发的腺病毒载体新冠疫苗I期实验结果整体有效,已率先4月22日进入2 期临床研究,有望6月揭盲,未来有望在海外进行更大范围的III期临床实验。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



