作者:蹊之
微信公众号: 蹊之美股生物医药
主要公司:Alnylam Pharmaceuticals (NASDAQ: ALNY)
包括公司:Medicines Company (NASDAQ: MDCO)
Dicerna Pharmaceuticals (NASDAQ: DRNA)
Arrowhead Pharmaceuticals (NASDAQ: ARWR)
Intellia Therapeutics (NASDAQ: NTLA)
Ionis (NASDAQ: IONS)
公司主页:http://www.alnylam.com
导言: 获得诺贝尔奖的RNAi技术,众星捧月!到没有效果,副反应太大,跌至谷底,罗氏、辉瑞、默沙东在内的诸多生物医药公司纷纷决定退场。再到默沙东旗下的Sirna公司出售给了Alnylam。最后在一片质疑声中,patisiran不断报出好结果,最终在2018年8月10日获美国FDA批准上市。为未来iRNA药物的批准开辟了先河。
To those who say “ impossible, impractical, unrealistic, ” we say: CHALLENGE ACCEPTED! 
Summary
20年的等待,美国FDA批准了首个RNA干扰药物,里程碑意义重大!
Alnylam的iRNA技术及ESC-GaINAc-RNAi技术平台简介及进展;
在研管线临床试验进展、有效性、安全性、市场、竞争者及估值分析;
公司合作及平台合作情况;
公司值得买吗?
一、Alnylam在RNAi治疗药物上的研发平台及进展
先看下GalNac-siRNA的结构和作用机制,下图显示双链RNA通过两种方式做成剂型,一种是包裹在纳米颗粒脂质体(Lipid Nanoparticles LNP)中(图左),通过LNP递送至肝脏,静脉给药,这就是现在被批准的ONPATTRO(Patisiran)的剂型。还有就是图右的那种,把双链链接在GalNAc的分子上,一共链接3个分子。这儿的RNA双链结构是通过(Glycol Nucleic Acid GNA) 作为RNA的骨架的,可以很好的减少脱靶效应,以及其带来的副作用(如肝脏毒性等问题),同时还可以提高很多药物效能的参数。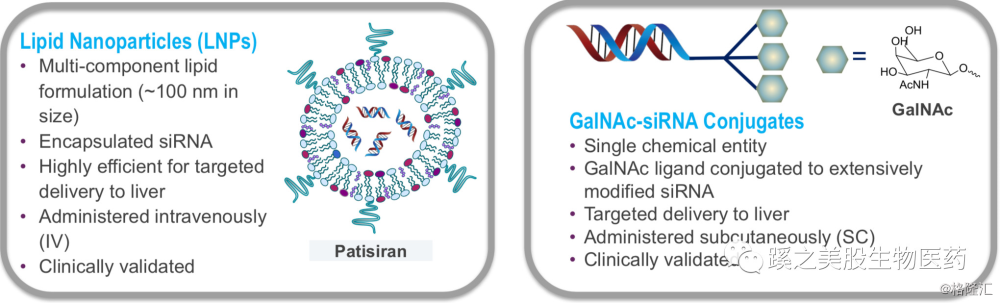 而这3个GalNAc分子在进入体内后,可以与肝脏表面的一种糖蛋白受体(Asialglycoprotein Receptor ASGPR)相结合,而进入肝细胞,在肝细胞内,3个GalNAc分子与RNA分离,ASGPR重新回到肝细胞表面。双链RNA中的反义连与RISC蛋白形成复合体,能把目标靶点蛋白的mRNA分解掉,从而使mRNA的对应的目标蛋白不能生成。见下图。
而这3个GalNAc分子在进入体内后,可以与肝脏表面的一种糖蛋白受体(Asialglycoprotein Receptor ASGPR)相结合,而进入肝细胞,在肝细胞内,3个GalNAc分子与RNA分离,ASGPR重新回到肝细胞表面。双链RNA中的反义连与RISC蛋白形成复合体,能把目标靶点蛋白的mRNA分解掉,从而使mRNA的对应的目标蛋白不能生成。见下图。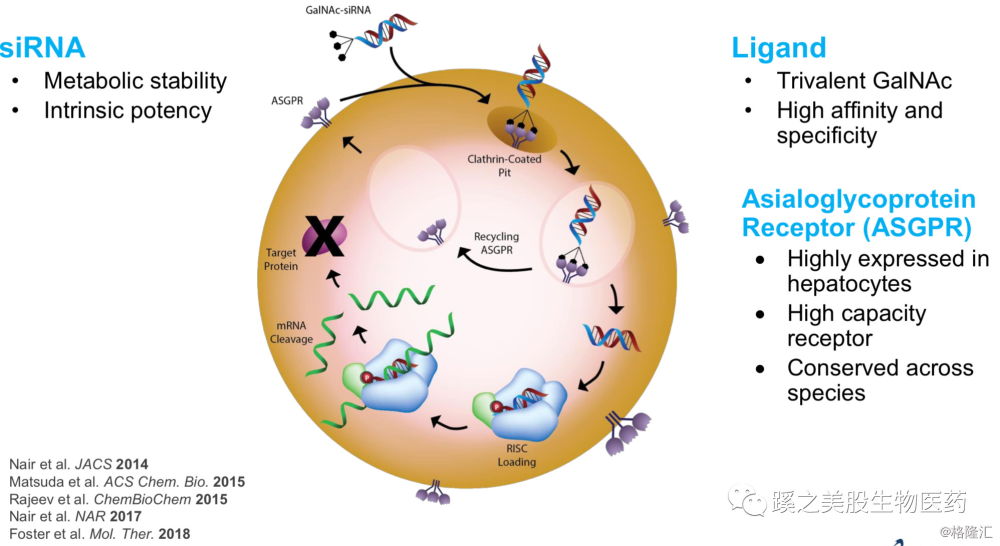
这样的机制有不少明确的优势,比如对不能成药靶点蛋白的直接作用,干扰效果可以多达99%,药物动力学非常有优势,在早期用药后,在间隔用药最少可至2次/年的皮下注射次数,并使目标蛋白一直处于稳定低表达,在常温下运输,皮下注射使用此药。药物的安全性在使用ESC-GalNAc的平台后,安全性得到了肯定,脱靶效应少,没有明显的血小板减少,肾毒性,系统性验证反应等。目前公司正在研发最新型的ESC+Conjugate的用药平台,靶向性更加优越。在2018年会申报INDs。
神经系统药物递送系统:公司在神经系统药物递送系统也有很大的进展,目前尚无神经退行性变疾病的较好的治疗方式,大到阿兹海默、帕金森,小到非常多的各种神经系统罕见病,目前这类疾病的不少靶点是明确的,iRNA药物能直接作用于这类基因相关的疾病。药物设计的方式如下图,双链RNA通过linker连接到配体,通过配体靶向至相应的器官,再通过siRNA药物至细胞内发挥作用。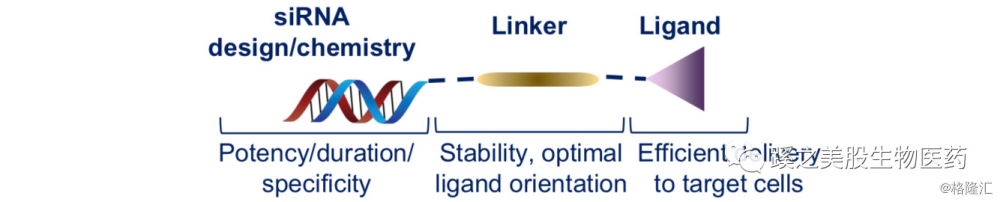
临床前的数据还不错,单次椎体内注射后,药物效果持续时间超过28天,耐受性也不错。公司计划于2019年底或2020年初申请IND,之后计划每年申请此类管线IND 1-2个。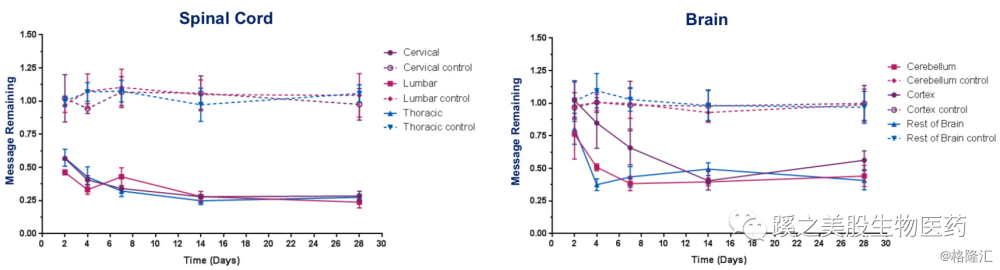 二、管线进展及分析
二、管线进展及分析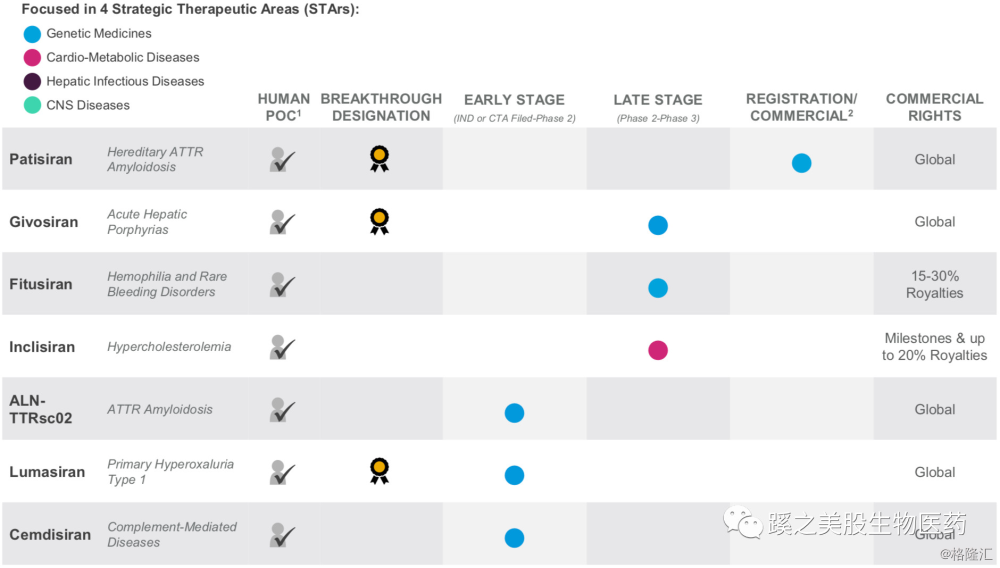 公司的管线见上图,2018年8月10日,FDA批准全球首款siRNA药物ONPATTRO(Patisiran),指征为遗传性甲状腺素转运蛋白淀粉样变性(hereditary transthyretin amyloidosis hATTR)多发神经病变。Alnylam是RNAi技术的领头羊,目前拥有除patisiran以外,6条成熟的研发管线。公司的其他管线的计划安排也非常紧凑,下图其他管线计划上市的时间,基本为每年1-2个产品。
公司的管线见上图,2018年8月10日,FDA批准全球首款siRNA药物ONPATTRO(Patisiran),指征为遗传性甲状腺素转运蛋白淀粉样变性(hereditary transthyretin amyloidosis hATTR)多发神经病变。Alnylam是RNAi技术的领头羊,目前拥有除patisiran以外,6条成熟的研发管线。公司的其他管线的计划安排也非常紧凑,下图其他管线计划上市的时间,基本为每年1-2个产品。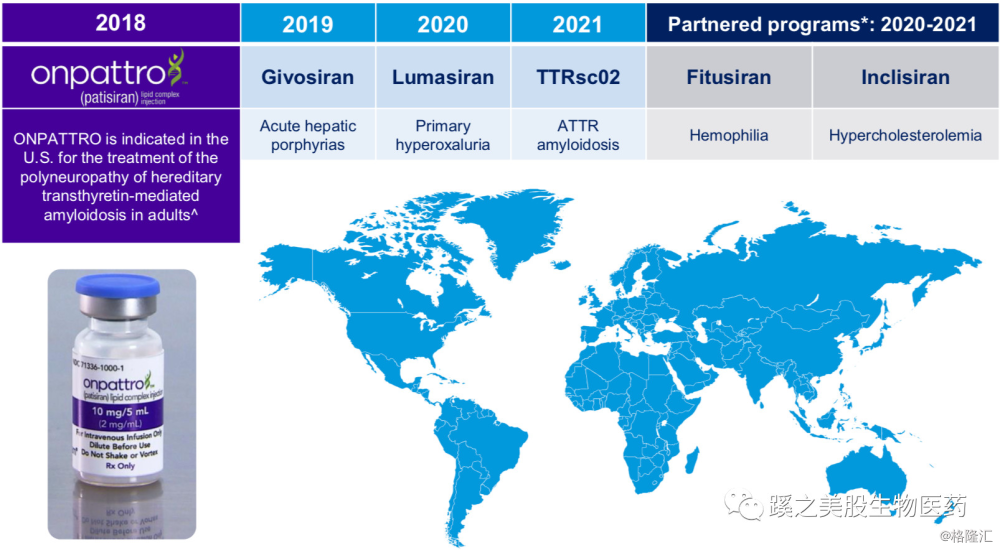
(一)ONPATTRO(Patisiran)
采用Arbutus公司授权的脂质体纳米递送技术开发的siRNA药物,干扰肝脏的甲状腺素转运蛋白的合成,适应症是hTTR多发性神经病变。主要的临床试验为APOLLO研究,结果显示与安慰剂对照,Patisiran每3周静脉注射一次,可以有效抑制肝脏甲状腺素转运蛋白的合成,对患者的神经功能和生活质量的改善迅速且持久,且无患者死亡报道,无药物相关的SAE报道,安全性较inotersen(INOS的反义RNA药物)更好。2018年7月28日已获得CHMP positive 的意见,EMA欧洲批准预计2018年9月。在日本,公司已于2018年中期递交JNDA材料。
Patisiran定价为$45万/年,$9500/支,实际支付可能为$34.5万/年。公司与部分保险公司达成协议,为无法从该药中充分获益的患者退还部分购药成本。
在今年6月,ALNY宣布接到美国FDA的下一代淀粉样变药物ALN-TTRsc02 (or “sc02”)的孤儿药设计。这个药物将采用公司的(ESC) GalNAc-siRNAs技术,将目前Patisiran的剂型改为皮下注射。即把双链RNA加上⼀种加强型化学分⼦,使siRNA具有更好的稳定性和肝脏靶向性。其专利保护期有近20年,这⼀技术花了ALNY10多年时间研发而成,是siRNA技术转化成临床可用药物的核⼼关键技术,具有强⼤的技术壁垒。
未来此管线计划,ALNY将做个单臂临床试验进行非劣性比较(采用ESC GalNAc-siRNAs技术的SC剂型与现在获批的ONPATTRO),在2020底-2021年初可以根据结果进行NDA申请。同时在辉瑞的tafamidis临床获批后,将进行头对头比较的临床试验。最后公司计划进行针对无症状携带者hTTR患者或者野生型TTR的临床试验,这将会是很大的潜在市场。
市场大小、竞争者、管线估值:
1. 市场大小(疾病定义及流行病学)
hATTR(Hereditary Transthyretin-mediated amyloidosis hATTR):甲状腺素转运蛋白(Transthyretin TTR)主要由肝脏产生,主要功能为转运Vitamin A,当TTR基因单个核苷酸发生突变是,甲状腺素转运蛋白错误折叠致系统性淀粉样变。这是一种罕见遗传病,全身进展性的淀粉样变沉积最终导致患者多器官功能衰竭(主要包括神经系统、心脏、消化道),最终死亡。据估计,在全球范围内,大约有5万例hATTR淀粉样变性患者。诊断后中位生存时间为4.7年,有心肌病的hATTR中位生存时间为3.4年,大于50%的神经病变患者合并有心脏病理,大于30%的心脏TTR患者有合并有神经病变。
野生型ATTR(Wild-type ATTR wtATTR)淀粉样变是非遗传性疾病,病因不清楚,但同样也是TTR蛋白的在多个器官的淀粉样积累,包括心脏中的积累,会导致心衰,患者会在2-6年死亡。wtTTR淀粉样变的流行病数据不确定,但估计在美国和欧洲,人数在20万人不到。而这一人群将是ALN-TTRsc02的扩大使用人群。
而ALNY现在被批的这个药物指征为FAP(familial amyloid polyneuropathy),其实就是hATTR的神经病变类型,就是下图中的PN类型。下图中CM为心脏病变类型,Mixed为PN及CM合并类型的患者。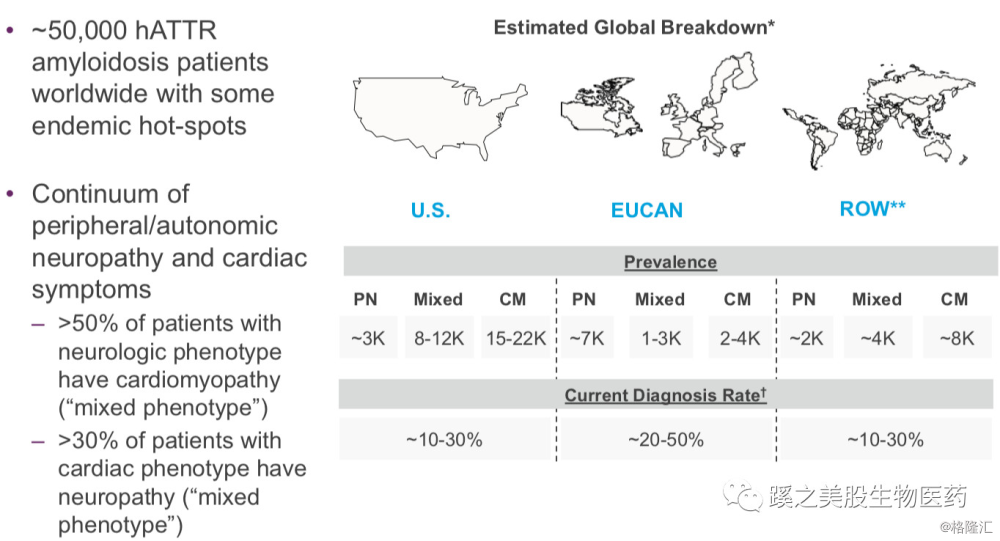
2. 竞争者
对于aHTTR指征,目前主要的手段是肝移植,肝移植费用高,手术风险大,而且移植成功后,很多病人的疾病仍然在进展,主要是由于TTR蛋白在外周的继续不断积累。目前辉瑞的Tafamidis在除美国以外的地区已被批准。看下具体这些竞争者的进展。
(1) Ionis的inotersen(2018年7月11日欧洲批准上市)和ALNY的patisiran在hATTR多神经病变这一指征上,形成强力竞争,从NEURO-TTR研究和APOLLO研究发表在同期NEJM上,就可见一斑。两药物一个是反义RNA药物,一个是RNA干扰药物,均靶向抑制肝脏甲状腺素转运蛋白合成。其疗效都得到3期临床试验的确认,用药方面,Tegsedi具有每周一次,皮下注射的便利性;但安全性方面,patisiran无药物相关病人死亡,明显更胜一筹。Tegsedi对血小板的影响太大,导致3例患者出现死亡。
Ionis的附属公司Akea计划开发新型的针对ATTR的反义药物,1期临床试验在2018年下半年开始。
(2) Pfizer (NYSE: PFE) 的tafamidis,指征为野生型ATTR,目前仅获批用于家族性淀粉样多发性神经病,该产品仅限于疾病早期使用,目前美国尚未上市。最近的tafamidis在TTR心肌病指征上的III期临床试验结果显示在30个月内,能明显降低所有原因导致的死亡率,以及由心血管引起的入院次数,具体数据可能在8月27日欧洲的心脏病学协会会议(European Society of Cardiology Congress)上公布。
(3) 还有一家公司Eidos Therapeutics(NASDAQ: EIDX)研发的AG10是一种口服的小分子药物,用以稳定四聚体TTR为目的。临床进展为II期,针对ATTR-CM(心肌病类型)。AG10具有良好的安全性和耐受性,能够在峰值浓度下稳定100%的血浆TTR,并在稳定状态下为>95%的(血浆TTR)提供平均稳定水平。而辉瑞的tafamids能稳定65%的血浆TTR四聚体。这家公司也值得关注。
(4) 还有Intellia Therapeutics, Inc.(NASDAQ: NTLA)公司,采用CRISPR体内基因编辑技术,治疗ATTR,管线处于临床前研究。公司采用体内导入CRISPR/Cas9和sgRNA,直接敲除TTR基因,从而降低TTR蛋白表达,采用脂质纳米(LPN)作为载体,传递Cas9和sgRNA。
(5) 还有GSK的miridesap及dezamizumab联合用药,miridesap用来分解血浆淀粉样蛋白,dezamizumab是抗体,用来作用于TTR形成的聚合物纤维。目前在临床2期,1期显示出一定的效果,但病例数太少。
(6) Prothena的PRX004,机制有所不同,直接作用于聚合物的TTR。注册了1期临床试验,至2018年14日还尚未见病人招募。
竞争者见下表格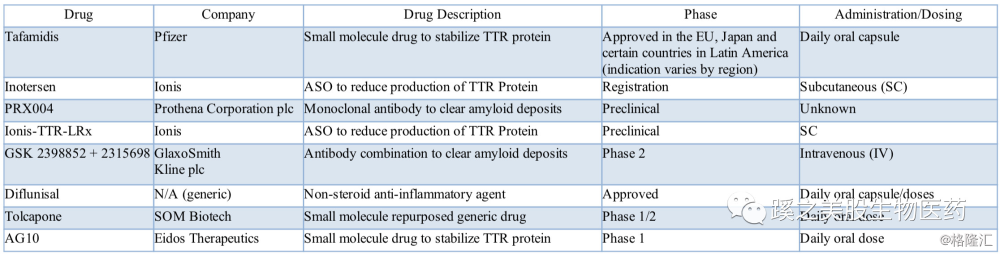
有机构预测patisiran的市场在第一个销售年有望达到$3.73亿,2022年有望达到$12.12亿美元(与本人的峰值销售预测相似,见后)。Inotersen的2019年销售预测仅为$1.06亿,2022年为$5.33亿。辉瑞的Vyndaqel(tafamidis)在2022年预测销售额仅为$1.7亿。
从机制上来说,tafamidis和AG10属于同一类稳定TTR四聚体的药物,从目前数据上来看,AG10的效果更优,但数据量较少。Ionis的Tegsedi以及Akea的新开发的药物,和inotersen属于同一类作用于RNA的药物,Tegsedi的安全性和有效性不如inotersen,Akea的药物过于早期。GSK和PRX004药物均属于作用于TTR及蛋白淀粉纤维(insoluble amyloid fibrils)的药物,病例数较少,而且GSK是双药连用,其中一个是抗体药,在安全性上有待观察。Intellia的管线过于早期,需看进一步数据。
3. 管线估值:
采用保守计算,美国这个获批指征的人数为3000,欧洲为7000,日本及其他国家可支付患者为2000,每年的药费为:$34.5万/人/年,欧洲及日本价格为美国一半。每年药价没有递增(实际上美国每年药价递增起码2%-9%以上,罕见病更多),因为有IONS的反义RNA等竞争产品,估计峰值的市场占有率为50%,未计算可能的off-label市场(主要指Mix的TTR类型)。6年后(2024年)的峰值销售为$5.175亿(美国),$7.763亿(欧洲及日本),共$12.938亿。discount rate为0.15,Peak*4,NPV为$22.373亿。截止2018年6月底在外发行股票为100.6M,每股贡献为$22.24/股。
附,临床试验结果:
IONS公司 - NEURO-TTR研究:国际多中心、随机、双盲、安慰剂对照,历时15个月,3期临床试验。纳入172名1期(可步行)和2期(辅助下可步行)有多神经病变症状的hATTR患者。受试者以2:1比例随机分为接受每周一次300mg inotersen皮下注射治疗组和安慰剂治疗组。主要终点是神经病变损害评分(mINS+7评分,modified Neuropathy Impairment Score+7,范围在-22.3 to 346.3,分数越高,意味着神经功能越差,评分改变≥2分有临床意义)和生活质量评分(Norfolk Quality of Life–Diabetic Neuropathy,QOL-DN,范围在-4 to 136,分数越高,生活质量越差)。研究结果:172名受试者中,有139名(81%)完成药物干预。从基线起到66w结束时,inotersen组与安慰剂组的mNIS+7评分变化差值是-19.7 points(95% CI -26.4 to -13.0; P<0.001);Norfolk QOL-DN 评分变化差值是-11.7 points (95% CI, -18.3 to -5.1; P<0.001)。这两个主要疗效评价指标上inotersen显著优于安慰剂。这两个指标的改善独立于疾病阶段、突变类型,与是否存在心脏病变无关。安全性:inotersen组有5例患者死亡,安慰剂组为0,最常见的SAE是肾小球肾炎(3例,3%)和血小板减少(3例,3%),其中1例死亡与4级以上的血小板减少有关。加强用药期间的监测对AE的早期发现和危险因素管理十分必要。该研究结果发表于2018年7月5日出版的NEJM。NEURO-TTR ClinicalTrials.gov number, NCT01737398。
ALNY公司 - APOLLO研究:国际多中心,随机,双盲,安慰剂对照,历时18个月,2:1分组,分为静脉注射patisiran 0.3mg/kg,每3周一次,和安慰剂组。主要终点除神经病变损害评分mNIS+7和生活质量评分Norfolk QOL-DN以外,还包括10m步行测速和营养状况指标。共纳入225例受试者,干预18个月后,patisiran与安慰剂相比mNIS+7评分变化差值是-34.0 points,P<0.001;Norfolk QOL-DN 评分变化差值是-21.1 points ,P<0.001;达到主要终点,另外,patisiran组与安慰剂组患者相比,还获得了10m步行速度和营养状况的显著改善。安全性方面,无受试者死亡报道,约有20%的patisiran组受试者和10%的安慰剂组受试者存在轻到中度的注射相关的AE,其他AE的发生率两组类似。该研究结果同样发表于2018年7月5日出版的NEJM。APOLLO Clinical Trails.gov number,NCT01960348。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



