Reminders for:纳斯达克生物科技公司系列
作者:蹊之
微信公众号:蹊之美股生物医药
Summary
Achaogen上市一日一次剂型氨基糖甙类抗生物ZEMDRI(Plazomicin)用于治疗复杂尿路感染;
Roche的PD-L1单抗在非鳞癌NSCLC指征临床试验结果上显得不给力;
一、Achaogen发售一日一次剂型氨基糖甙类抗生物ZEMDRI(Plazomicin)用于治疗复杂尿路感染
公司:Achaogen, Inc. (NASDAQ:AKAO)
药物:ZEMDRI(Plazomicin)
指征:复杂尿路感染(complicated Urinary Tract Infections cUTI),包括肾盂肾炎。
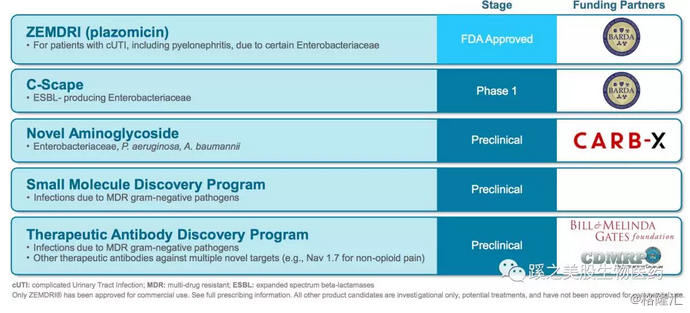
公司管线
事件
SOUTH SAN FRANCISCO, Calif., July 20, 2018 — Achaogen宣布ZEMDRI正式在美国上市,指征为ZEMDRI指征为:18岁及以上成人的复杂尿路感染,包括肾盂感染。这些感染由以下敏感细菌引起:大肠埃希杆菌,肺炎克雷博杆菌,奇异变形杆菌,肠道阴沟杆菌。由于目前对于ZEMDRI的有效性和安全性数据有限,ZEMDRI保守用于选择有限或者没有选择的cUTI患者。ZEMDRI在今年6月25日被美国FDA批准,批准主要依据EPIC的临床试验数据。
ZEMDRI剂型为500 mg/10 mL (50mg/mL),每盒有10支药物,静脉滴注,1次/日,每次静脉滴注30分钟,剂量主要根据患者体重和肾功能进行调整,Achaogen预计,每名患者的标准治疗剂量一般为3支/日。ZEMDRI的销售将通过专业的经销商进行销售,如ASD Healthcare( a company of AmerisourceBergen), Cardinal Health Specialty Distribution, FFF Enterprises,McKesson Plasma 和 Biologics。
Reminder
仅在美国,ZEMDRI的cUTI适应症市场约$1.8B。按照目前的销售安排,今年Q3的销售业绩将会看到这一指征的市场销售情况。公司具体的分析及估值情况请看之前发布的关于AKAO的长文分析。近阶段,抗生素研发被大药厂不断的削减,板块估值也直线下降,但抗生素的耐药问题却越来越严重,这一板块在今年和明年应该为重点关注。
背景
Achaogen (NASDAQ:AKAO)是一家研发多重耐药抗生素的生物科技公司,特别是针对于碳青霉烯耐药的细菌( carbapenem-resistant Enterobacteriaceae CRE ) ,这是目前抗生素领域最为棘手的问题,与β-内酰胺酶耐药被美国CDC及世界卫生组织WHO列为头号最紧急、最严重的警示。公司的主要产品为Plazomicin,2018年6月26日被美国FDA批准,指征为:复杂尿道感染(complicated urinary tract infections cUTI),包括了肾盂肾炎。bloodstream infections BSI指征由于数据量不够,未被批准。C-Scape管线比较早期,临床前数据亮眼,也非常有前景,市场也是很巨大。
二、Roche的PD-L1单抗在非鳞癌NSCLC指征临床试验结果上显得不给力
公司:Roche(OTCQX:RHHBY)
药物:atezolizumab
指征:非鳞癌非小细胞肺癌(NSCLC)
事件
罗氏于7月19日宣布了 IMpower 132 的临床试验 top-line 结果,该项研究评估了PD-L1 atezolizumab联合化疗作为一线治疗进展性、非鳞状非小细胞肺癌的疗效。该研究达到其中一个co-primary终点,即无进展生存时间(Progress-Free Survival PFS)。但是,另一个co-primary 终点,总体生存率(Overall Survival OS),从目前部分的数据来看,没有达到统计学差异。说明到目前为止,与化疗相比,加用 atezolizumab 并没有延长NSCLC患者的生存时间。
Reminder
OS目前还需一个相当长的时间观察才能统计出最终终点结果,因此atezolizumab到底能否改善OS,在试验全部结束之前,还得不到最终定论。但是,目前这数据对atezo-chemo 这个治疗组合来说一定会带来压力,因为,Merck的PD-1在之前就已批准用于与化疗药联合治疗肺癌的一线用药,而且,Merck的PD-1作为一线单药治疗指征,三期临床试验结果已显示出比化疗药更好的PFS及OS结果。所以,如果罗氏要想在未来与Merck起头并进,需要的不仅仅是联合用药的效果和安全性,还有单用药的效果和安全性指标。
背景
罗氏发起的IMpower132是一项随机、多中心、公开标签的3期临床试验。该试验招募的是化疗初治,且处于IV期的非鳞状非小细胞肺癌患者。该试验不接受出现EGFR突变或ALK融合的患者。它主要评估使用PD-L1单抗 atezolizumab与顺铂或卡铂与培美曲塞组合(分组:atezolizumab+顺铂或卡铂与培美曲塞,顺铂或卡铂与培美曲塞)疗效和安全性,主要终点为PFS及OS。
由Merk发起的KEYNOTE-042 试验研究结果已于2018年6月在美国 2018 ASCO 大会上公布。这项关键的三期临床研究旨在评估pembrolizumab作为单药一线治疗局部晚期或转移性无 EGFR/ALK 驱动基因突变的非小细胞肺癌(NSCLC)的相关疗效。结果显示:pembrolizumab单药使用相比铂类药物化疗(卡铂 + 紫杉醇或卡铂 + 培美曲塞)可显著延长 PD-L1 表达阳性(TPS ≥ 1%)患者的总生存期(OS)。其中,TPS ≥ 50% 的人群的死亡风险降低了 31% (HR = 0.69 [95% CI, 0.56-0.85]; p = 0.0003)。而pembrolizumab与化疗药的联合使用指征,已被美国FDA批准。
Disclosure: I am/we are long AKAO
个人能力有限,难免有疏漏或不正确之处,请多多指出,谢谢!
Disclaimer: 以上的文章及观点并非个人的投资建议,如果想要进行交易,读者需要自己进行勤奋的调研或者咨询专业投资者。我会尽我所能去展示真实的调研,但我不能保证信息的精确性。投资这类公司可能会导致本金部分或者全部损失。换而言之,读者需要有自己的交易计划,有自己的研究,并为自己的交易负责。如果没有能力或者意愿去做这些,建议您最好买入指数型ETF基金,或者请您信任的专业人士来处理您的投资账号。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



