多年来,标准灭活流感疫苗是全球范围内使用最为广泛的流感疫苗类型,但其对流感病毒的预防效力仍有明显的提升空间,这也成为众多新型流感疫苗的创新突破点。中金研究注意到海外已有多款创新流感疫苗上市,包括高剂量灭活流感疫苗、佐剂流感疫苗以及重组流感疫苗等,其凭借高保护效力方面的优势保持稳定增长趋势。据中金研究测算,2022年流感季海外新型流感疫苗销售额占比已经超过50%。中金研究在本篇报告中梳理了海外创新流感疫苗的发展趋势与代表企业/产品,建议关注国内相关布局新型流感疫苗的企业。
摘要
创新流感疫苗拉动海外流感疫苗市场稳定扩容。海外流感疫苗市场近年来保持稳定增长,中金研究根据海外流感疫苗企业公告测算,2022年全球规模达约60亿美元,2015-2022年CAGR约11%,其中新型流感疫苗约33亿美元,2015-2022年CAGR超25%,占比约56%。赛诺菲和CSL是海外流感疫苗市场的主要生产商,2022年市占率分别为53%和28%。赛诺菲采用差异化产品战略,旗下Fluzon高剂量流感疫苗和Flublok重组流感疫苗22年合计销售额达18亿欧元,占其流感疫苗业务收入的60%。CSL同样专注于创新疫苗,旗下Flucelvax细胞培养流感疫苗和Fluad佐剂流感疫苗22年分别占其流感业务收入的37%和54%,合计销售额达15亿美元。考虑到创新疫苗的产品优势以及海外流感疫苗龙头的发力侧重,预计未来创新流感疫苗占有率仍将持续提升。
ACIP主要推荐创新流感疫苗用于65岁及以上老年人。美国免疫实施咨询委员会(ACIP)推荐65岁及以上老年人优先推荐三款升级版本疫苗,即高剂量灭活流感疫苗、重组流感疫苗和佐剂流感疫苗。相比于标准流感疫苗,高剂量流感疫苗可将患流感的风险降低24%,而重组流感疫苗可降低30%,且重组流感疫苗安全性明显优于高剂量灭活流感疫苗。佐剂流感疫苗整体有效性较好,但对H3N2的预防效力和安全性仍待提高。从目前披露临床数据分析,中金研究认为重组流感疫苗的有效性和安全性较为突出,其有望成为未来流感疫苗升级的主要方向之一。
mRNA在流感疫苗的技术优势和应用潜力需要更多证据。理论上mRNA研发及规模化生产效率高以及避免适应性突变的诸多优势非常契合流感病毒疫苗的设计要求,但mRNA流感疫苗尚未展现出明显优于标准流感疫苗的预防效力,且除mRNA-1010 (Moderna) 外的mRNA流感疫苗仍存在对乙型流感病毒反应较低等问题。中金研究建议关注mRNA-1010的上市申报进程,以及mRNA流感疫苗与其他呼吸道传染病疫苗的联合潜力。
风险
疫苗安全性风险,疫苗研发进度不及预期。
正文
核心总结
流感疫苗是目前全球第三大疫苗品类,传统主流灭活路线在有效性等方面存在改进空间。按开发路径区分,目前已上市流感疫苗包括流感灭活疫苗(包括鸡胚培养和细胞培养)、流感减毒活疫苗和重组蛋白疫苗等。灭活疫苗生产工艺成熟、安全性高以及价格便宜,是全球范围内使用最广泛的流感疫苗;然而,据美国疾病预防控制中心[1](Centers for Disease Control and Prevention,CDC),目前主流灭活疫苗提供的保护力仍较低(若疫苗与流行毒株匹配,保护效力可达40-60%),特别是对老年人(65岁及以上)的保护率更低,且灭活流感疫苗对甲流H3N2的保护率有限,存在进一步改进的空间。
图表1:海外疫苗市场拆分(2022年,按销售额)

注:按照辉瑞、默沙东、GSK、赛诺菲、CSL、阿斯利康等企业公布疫苗收入计算资料来源:各公司公告,中金公司研究部
图表2:海外流感疫苗市场拆分(2022年,按销售额)

注:按照辉瑞、默沙东、GSK、赛诺菲、CSL、阿斯利康等企业公布疫苗收入计算
资料来源:各公司公告,中金公司研究部
为解决灭活疫苗的不足,2009年以来已有多种新型流感疫苗先后被开发并推进至上市,目前正在逐渐替代传统灭活疫苗成为新的主流路线。
► 标准灭活流感疫苗(IIV):IIV是全球最主流的流感疫苗,生产工艺成熟,适用人群全面覆盖儿童到老年人群,安全性表现优秀,且价格低廉,但该疫苗容易产生抗原性改变,对H3N2的预防效力较差,生产周期较长,鸡胚相关成分也可能导致接种者出现过敏反应。
► 细胞培养流感疫苗(ccIIV):ccIIV是在IIV基础上的升级类型,采用细胞培养替代传统鸡胚培养,克服了生产周期长和抗原性易改变的问题,但该疫苗保护力优势不稳定,现有证据[2]显示其更容易在H3N2流感季拥有更高的保护效力。
► 减毒活流感疫苗(LAIV):LAIV模仿流感病毒自然感染过程,通过鼻腔喷雾法接种,可同时激活粘膜免疫和全身性免疫反应,主要用于2-49岁人群接种。LAIV代表性产品为阿斯利康的FluMist,其有效性和安全性与标准流感疫苗相当。
► 高剂量灭活流感疫苗(IIV-HD):IIV-HD疫苗含有4倍的抗原剂量,主要用于65岁及以上人群接种。与标准剂量流感疫苗相比,在50岁及以上成人中,高剂量流感疫苗可进一步降低24%患流感的风险,但该产品不良事件高于标准流感疫苗,且定价较高。IIV-HD代表性产品是Fluzon HD,已获得ACIP推荐用于65岁及以上老年人。
► 佐剂流感疫苗(aIIV):aIIV代表性产品是Fluad,一款使用MF59创新佐剂的亚单位流感疫苗。该疫苗在65岁及以上人群的保护效力优于标准疫苗,但该疫苗的接种后不良反应也明显多于标准疫苗。该疫苗仍采用鸡胚培养技术,对H3N2的预防效力较低。该产品定价与Fluzon HD类似,均高于标准流感疫苗。
► 重组流感疫苗(RIV):RIV采用杆状病毒表达系统生产血凝素抗原,保证疫苗和野生型流行流感病毒血凝素完全一致。代表性产品是Flublok,其含有3倍的抗原剂量,与标准剂量四级流感疫苗相比,在50岁及以上成人中,重组四价流感疫苗可进一步降低30%患流感的风险,且安全性表现与准剂量流感疫苗类似。Flublok可用于18岁及以上人群接种,但其定价也高于标准流感疫苗。
图表3:各类流感疫苗对比

注:√代表该适应人群已获批;●越多,表示疫苗在该项评价上表现越好 mRNA流感疫苗的适用人群和定价待获批上市后确定。 资料来源:中金公司研究部
中国流感疫苗研发仍处于对标追赶阶段。整体上看,海外赛诺菲、CSL、Moderna等疫苗企业均已将流感疫苗研发重心转向重组蛋白、mRNA等非蛋类流感疫苗制造技术,海外较高的疫苗接种率和成熟的保险支付环境也为创新流感疫苗的商业化创造了条件。国内市场目前仍以灭活流感疫苗为主,同时亦有个别企业正在开发细胞培养流感疫苗,但对重组流感疫苗和mRNA流感疫苗的布局仍较有限。
国内流感疫苗接种意识处于提升阶段,关注后续接种率变化。受限于居民对流感的认识不足以及流感疫苗的自费属性,国内流感疫苗的接种率[3]常年维持在3-5%的较低水平,国内流感疫苗的商业化潜力仍有待释放。中金研究注意到近两年国内流感疾病负担较重,叠加各地政府陆续推出流感疫苗免费接种政策,流感疫苗的供给能力亦有所加强,居民的流感疫苗接种意愿逐步提升。考虑到灭活流感疫苗安全性可靠和价格便宜的特点,中金研究认为其仍是现阶段国内流感疫苗推广普及的优先选择之一,但国内企业对新型流感疫苗的布局与开发也值得关注。
中性假设下,预计国内流感疫苗市场规模有望达到110亿元,对应全人口接种率约9%。预计各年龄组流感疫苗接种率相较2020-21年流感季增加一倍,疫苗平均价格下滑到80-90元/剂,则国内流感疫苗市场规模为110亿元。值得注意的是,参考海外新型流感疫苗定价往往高于标准流感疫苗,中金研究认为未来新型流感疫苗上市后有望进一步扩容市场规模。
从美国流感疫苗升级历史看国内迭代方向
在美国市场,新型流感疫苗近年来正逐步取代传统灭活疫苗。据国内外流感疫苗接种指南,接种流感疫苗是预防流感相关感染、减少住院及预防死亡最有效的策略。20世纪30年代,流感病毒被发现可在胚胎卵中培养,而后以灭活裂解为代表的传统流感疫苗被开发上市并成长为全球最大的疫苗品类之一;随着行业的发展,更多创新疫苗技术被运用于流感疫苗开发并陆续有产品上市。以流感疫苗接种政策及品类相对完善的美国市场为例,目前已有5种不同路径的创新流感疫苗上市,据美国CDC,2022-2023年其接种市占率已达20%。本篇报告通过复盘美国流感疫苗技术升级迭代历史,为未来国内流感行业投资方向提供参考。
流感疫苗研发历史:创新流感疫苗瞄准灭活流感疫苗有效性不足、潜在鸡蛋过敏和生产周期长的痛点
鸡胚生产灭活流感疫苗(IIV)是全球最早成功开发的流感疫苗,也是目前应用最广的技术路线。20世纪40年代,科学家通过将流感病毒接种于鸡胚尿囊腔中,病毒成熟后收集尿囊液,经历灭活、离心、浓缩、纯化后得到病毒原液,开发了最早的流感全病毒灭活疫苗,此类疫苗于1948年在美国上市;在流感全病毒灭活疫苗基础上,通过裂解去除病毒核酸和大分子蛋白质,仅保留有效抗原成分可制得灭活流感疫苗,此类疫苗于1968年率先在美国上市,至今仍是全球使用最为广泛的流感疫苗类型,2023年美国使用率约80%(据美国CDC),中国使用率超过95%(中金研究根据中国中检院批签发数据测算)。20世纪50年代,科学家在裂解流感疫苗基础上,通过进一步裂解抗原成分并提纯,得到了流感病毒亚单位疫苗,进一步改善了安全性。
灭活流感疫苗技术早在20世纪50年代便已成熟,但始终未能突破流感病毒抗原性易变和鸡胚生产技术限制条件较多等挑战:1)在灭活流感疫苗生产过程中,连续的流感病毒(例如H3N2)传代可导致抗原位点的卵适应性突变,导致抗原性改变,从而降低疫苗的有效性;2)鸡胚生产满足量产条件至少需要3-4个月,在流行亚型预测失准的情况下不具备临时改进的能力,且鸡胚质量和供应量会直接影响疫苗供应。根美国CDC,2022-23年流感季节,流感疫苗在65岁及以上人群中的保护效力为35%。
图表4:流感疫苗发展关键节点

资料来源:Reviews in Medical Virology,中金公司研究部
为了克服上述缺点,国内外流感疫苗企业转向新型流感疫苗研发。20世纪60年代,科学家发现哺乳动物细胞可替代鸡胚生产流感病毒,其中代表性细胞株是MDCK(Madin–Darby canine kidney)细胞系。基于MDCK细胞系开发,2007年全球第一款基于细胞培养的流感疫苗(Flucelvax)率先在欧洲上市。Flucelvax仍采用病毒传代培养的方式生产全病毒,疫苗的主要活性成分血凝素与其他非活性成分混合存在,而人体基于血凝素产生的中和抗体才是对抗流感病毒主要工具,因此细胞培养路线仍有提升空间。随后,科学家采用杆状昆虫病毒表达系统和重组DNA技术直接生产流感病毒血凝素抗原,用于制造重组流感疫苗,并于2013年在美国率先上市,该疫苗领先的技术路线也为其带来保护率高和安全性好的双重优势。
截至目前,美国已上市的新型流感疫苗包括高剂量灭活流感疫苗(Fluzone High-Dose Quadrivalent),佐剂流感疫苗(Fluad Quadrivalent),细胞培养流感疫苗(Flucelvax Quadrivalent),以及重组流感疫苗(Flublok Quadrivalent);在研品种包括mRNA疫苗、腺病毒载体疫苗、病毒样颗粒疫苗以及通用型疫苗等。
图表5:美国上市流感疫苗(2022-2023年流感季)

资料来源:美国CDC,中金公司研究部
美国CDC对流感疫苗持无差别推荐态度,针对老年人的流感疫苗除外。自2010年以来,美国CDC和免疫实践咨询委员会(ACIP)建议对所有年龄≥6个月且无禁忌症的人进行常规年度流感疫苗接种。2022年6月,ACIP一致投票决定向65岁及以上老年人优先推荐三款升级版本疫苗,即Fluzon高剂量四价流感疫苗、Flublok四价重组流感疫苗和Fluad四价佐剂流感疫苗。
得益于可为老年人提供更有效的保护力,这三款疫苗近几年销售额保持稳步提升,并逐步取代传统灭活裂解流感疫苗。根据美国FDA数据,近年来三款老年人推荐疫苗的批签发批次占比逐步提升至40%左右,其中Flublok四价重组流感疫苗占比提升至20%,Fluad四价佐剂流感疫苗占比提升至15%。
图表6:全球流感疫苗销售收入(未包括国内流感疫苗企业,2011-2022年)

注:CSL未公告2015年之前流感疫苗收入 资料来源:各公司公告,中金公司研究部
图表7:美国流感疫苗批签发批次

注:美国流感疫苗批签发批次与国内类似,不同批次包括疫苗数量不等,该数据仅供参考 资料来源:FDA,中金公司研究部
图表8:美国流感疫苗批签发批次占比

资料来源:美国FDA,中金公司研究部
复盘赛诺菲流感业务,高剂量灭活疫苗和重组蛋白疫苗已成为核心增长点
赛诺菲是全球流感疫苗龙头,全球市场份额超50%。1948年美国宾夕法尼亚州斯威沃特的Pocono生物实验室(今属赛诺菲巴斯德)诞生了第一支流感疫苗,至今公司流感疫苗已在全球拥有70年使用历史,并在在全球100多个国家上市。目前公司已在在全球拥有法国、美国、加拿大、墨西哥和中国深圳五大流感疫苗生产基地,每年为全球提供超过2.5亿剂的流感疫苗。公司致力于不断改进流感疫苗研发,已拥有灭活裂解、重组蛋白、mRNA(在研)等多个流感疫苗生产平台。
图表9:赛诺菲流感业务收入情况(2018-2022)

资料来源:公司公告,中金公司研究部
公司近年来持续拓展非蛋类流感疫苗制造技术,以通过差异化产品战略不断强化其在流感疫苗领域的领先地位。如前文所述,公司灭活流感疫苗始终未能解决抗原性突变和生产限制多的问题,导致其在流感易感人群中——特别是老年人中——的预防效力较低。为提高流感疫苗在老年人的免疫应答和保护效果,赛诺菲直接将疫苗中每种抗原组分的含量由标准的15ug提高到60ug,于2009年推出了Fluzon高剂量灭活流感疫苗(对流感保护效力比 Fluzone灭活疫苗高24%)。但Fluzon在提升保护效力的同时,也带来了更加明显的安全性问题,因此公司继续探索替代传统鸡胚生产的创新技术。2017年,公司通过收购Protein Sciences获得Flublok重组流感疫苗(对流感保护效力比 Fluzone灭活疫苗高30%,且安全性与标准流感疫苗类似),解决了老年人流感疫苗安全性不足的缺陷。目前这两款产品已成为公司流感业务的核心增长点,2022年来合计占公司流感疫苗业务收入的60%。
图表10:赛诺菲的流感疫苗发展历程

资料来源:公司公告,中金公司研究部
Fluzon高剂量流感疫苗:流感保护效力提升24%,安全性仍有改良空间
Fluzon高剂量流感疫苗免疫原性具备优势,但安全性尚有提升空间。FDA在2009年批准了赛诺菲的Fluzone高剂量三价流感疫苗,适用于65岁及以上老年人,并在2019年批准了Fluzone高剂量四价流感疫苗。与标准剂量流感疫苗相比,高剂量流感疫苗含有4倍的抗原剂量[4],其接种后诱导产生的A/H1N2和A/H3N2 HAI(hemagglutination inhibition test, 血凝抑制试验)滴度明显提高,但对乙型流感病毒仅为非劣。研究4显示,在65岁及以上成人中,高剂量流感疫苗可进一步降低24%患流感的风险。2018-2019年流感季,赛诺菲为美国提供了1.12亿剂量Fluzone高剂量流感疫苗,接种流感疫苗的65岁及以上人群中约2/3选择了该款产品;近年来Fluzone高剂量疫苗的占比持续下滑,预计主要受到了其他老年人流感疫苗的放量冲击。
值得注意的是,目前美国使用的Fluzone高剂量四价流感疫苗安全性和Fluzone高剂量三价流感疫苗类似,其接种后常见不良反应包括注射部位疼痛(41.3%)、肌肉疼痛(22.7%)、头痛(14.4%)和不适(13.2%),高于标准流感疫苗。不良反应通常出现在接种疫苗前三天内,大多数症状会自行缓解。此外,Fluzon高剂量流感疫苗定价也明显高于标准剂量。
图表11:Fluzone高剂量在美国65岁及以上老年人流感疫苗中的市场份额

资料来源:公告公告,中金公司研究部
图表12:Fluzon高剂量流感疫苗对甲/乙型流感的预防效力

注:IIV3-HD,Fluzone高剂量三价流感疫苗;IIV3-HD,标准三价流感疫苗 资料来源:DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, Pollak R, Christoff J, Earl J, Landolfi V, Martin E, Gurunathan S, Nathan R, Greenberg DP, Tornieporth NG, Decker MD, Talbot HK. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 2014 Aug 14;371(7):635-45. doi: 10.1056/NEJMoa1315727. PMID: 25119609.,中金公司研究部
图表13:Fluzone高剂量三价流感疫苗和Fluzone三价流感疫苗接种后7天局部和全身不良反应对比

注:65岁及以上人群 资料来源:Falsey AR, Treanor JJ, Tornieporth N, Capellan J, Gorse GJ. Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. J Infect Dis. 2009 Jul 15;200(2):172-80.,中金公司研究部
Flublok重组流感疫苗:流感保护效力提升30%,安全性良好
Flublok是全球首款上市的重组蛋白流感疫苗。Protein Sciences开发了用于重组蛋白质生产的杆状病毒表达系统技术(BEVS)平台,并运用此平台成功开发了Flublok重组流感疫苗。Flublok三价重组流感疫苗在2013年1月获FDA批准上市,适用于19-49岁人群预防季节性流感,随后2014年10月适用人群拓展至18岁及以上人群。迭代产品Flublok四价重组流感疫苗于2016年10月获FDA批准上市,用于18岁及以上成年人针对季节性流感的主动免疫。2017年8月,赛诺菲支付6.5亿美元首付款和1亿美元里程碑付款100%收购Protein Sciences,将Flublok四价流感疫苗纳入公司流感疫苗资产。
Flublok四价流感疫苗免疫原性优势突出,且安全性良好。不同于传统鸡胚生产的流感疫苗,重组四价流感疫苗采用昆虫细胞生产流感病毒特异性抗原,可降低生产过程中毒株发生适应性突变引起的疫苗株匹配度下降和疫苗有效性较低的风险,能够更好保证所生产的疫苗与WHO每年推荐的流感疫苗生产毒株达到精确的基因匹配。与标准剂量流感疫苗相比,该疫苗含有3倍的抗原剂量,接种后其诱导的针对A/H1N2和A/H3N2的HAI滴度明显提高,对乙流也有小幅度提高;研究显示[5]在50岁及以上成人中,重组四价流感疫苗较标准流感疫苗可进一步降低30%患流感的风险。此外,该疫苗不良反应风险和标准剂量四价流感疫苗类似。
图表14:Flublok(RIV4)对甲/乙型流感的预防效力

资料来源:Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, Cox MMJ; PSC12 Study Team. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. N Engl J Med. 2017 Jun 22;376(25):2427-2436. doi: 10.1056/NEJMoa1608862. PMID: 28636855.,中金公司研究部
图表15:Flublok(RIV4)的安全性数据
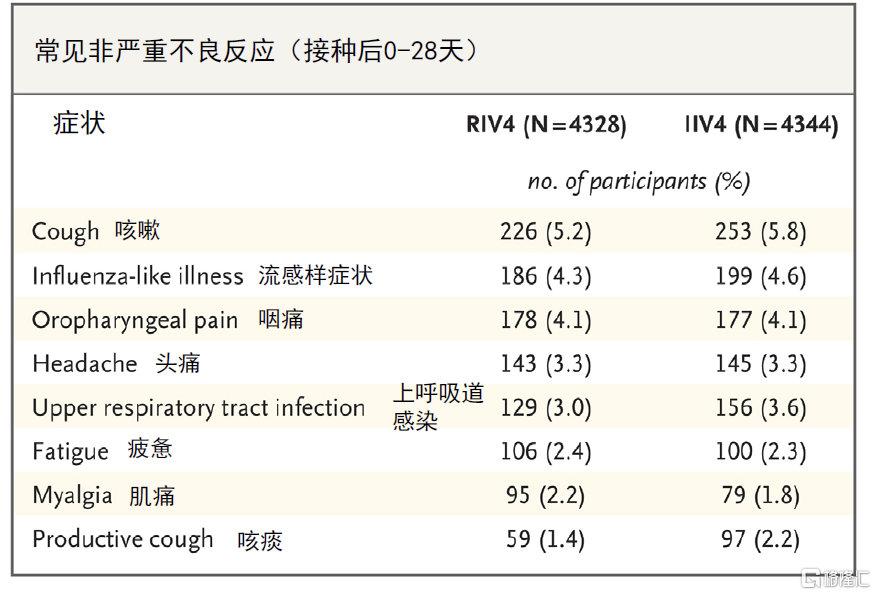
资料来源:Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, Cox MMJ; PSC12 Study Team. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. N Engl J Med. 2017 Jun 22;376(25):2427-2436. doi: 10.1056/NEJMoa1608862. PMID: 28636855.,中金公司研究部
杆状病毒表达载体系统(BEVS)是重组流感疫苗开发成功的关键。BEVS是一种利用杆状病毒作为外源基因表达系统,可通过替换病毒中的非必需基因来实现外源基因的扩增和蛋白表达。该系统主要由转移质粒、杆状病毒载体和昆虫宿主细胞系组成,先借助E.coli细胞系将外源基因导入杆状病毒载体,随后让杆状病毒载体在昆虫宿主细胞系中表达目的蛋白,用于制作疫苗。与传统的疫苗生产平台相比,BEVS平台具备制造速度快、产品设计灵活、安全性高、可扩展性强的优点。以流感疫苗生产为例,鸡胚流感疫苗生产至少需要3-4个月,而BEVS衍生的流感疫苗只需要1.5个月,且能够保证目的基因的完整转录和修饰。目前BEVS已成功应用于10余种疫苗开发,包括Cervarx(GSK 2价HPV疫苗)、Flublol、NVX-CoV2373(Novavax新冠疫苗)等。
图表16:基于杆状病毒表达载体系统(BEVS)的疫苗制备过程

资料来源:Hong, Q., Liu, J., Wei, Y., & Wei, X. (2023). Application of Baculovirus Expression Vector System (BEVS) in Vaccine Development. Vaccines, 11.,中金公司研究部
复盘CSL Seqirus流感业务,细胞培养流感疫苗和佐剂流感疫苗稳定成长
CSL Seqirus是全球第二大流感疫苗生产商。2014年CSL通过收购诺华旗下的全球流感疫苗业务取得鸡胚培养和细胞培养流感疫苗技术,以及专有的佐剂平台,并于2015年将该部门与CSL的子公司bioCSL合并,联合企业更名为Seqirus。CSL目前在美国、英国和加拿大建立三大流感疫苗生产基地,每年可为全球20多个国家/地区提供超1亿剂流感疫苗。
图表17:CSL Seqirus流感疫苗业务收入拆分

资料来源:公司公告,中金公司研究部
CSL Seqirus基本直接沿用了诺华疫苗业务的技术路线。1990年开始,海外许多公司致力于研究新型佐剂,以提高疫苗的保护效力;诺华早在1992年成功开发了MF59佐剂,并将MF59应用于佐剂流感疫苗Fluad,该疫苗最早于1997年在意大利上市,并于2015年在美国上市。为进一步提高疫苗业务竞争力,诺华于2006年并购了美国疫苗巨头Chiron,此时Chiron是仅次于赛诺菲的美国第二大流感疫苗供应商,主要产品是FlurVirin(三价灭活流感疫苗,1988年获FDA批准上市)。2009年全球甲型H1N1流感大流行,各国急需流感疫苗,但基于鸡胚生产的灭活流感疫苗难以在短时间内大量生产。该事件后,各国政府和疫苗公司开始积极推动流感疫苗生产工艺的进步。2012年诺华的Flucelvax细胞培养流感疫苗获FDA批准上市,旨在流感大流行时可快速建立疫苗储备。CSL收购诺华流感疫苗后,继续推进Flucelvax细胞培养流感疫苗和Fluad佐剂流感疫苗的商业化拓展,目前两款产品已成长为CSL流感业务的核心增长点,2022年Flucelvax占公司流感疫苗业务收入的37%,Fluad占54%。
图表18:CSL的流感疫苗发展历程

资料来源:公司公告,中金公司研究部
Flucelvax细胞培养流感疫苗:安全性良好,但保护力优势不稳定
Flucelvax细胞培养流感疫苗对不同流行毒株的保护力优势差距较大,安全性良好。Flucelva最早由诺华开发,2012年获FDA批准上市,适用于6个月及以上人群。Flucelva基于MDCK(Madin–Darby canine kidney)细胞系开发,MDCK细胞系被公认为最适合流感病毒毒株分离和疫苗生产的细胞系之一,流感病毒可在MDCK细胞中迅速复制,在3-10代内即可获得高产病毒株,缩短疫苗生产时间并降低传代过程中适应性突变的可能性。此外,该细胞系较易于适应无血清培养基,以及无血清悬浮驯化,有利于大规模产业化生产。据美国CDC,在2017-2018年流感季,针对65岁及以上人群,基于细胞培养的流感疫苗可提供更好的保护效力,但是在2018-2019年和2019-202年流感季未观察到该差异。现有证据提示细胞生产流感疫苗更可能在H3N2流感季拥有更高的保护效力。
图表19:2017-2018年流感季,针对流感相关住院的流感疫苗相对有效性
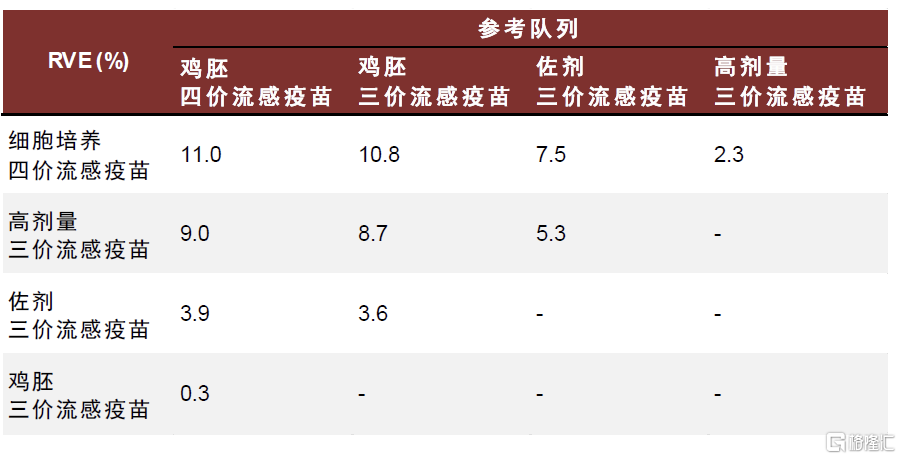
注:RVE,相对疫苗保护率,即相对参考队列的疫苗保护率,值越大代表相对参考疫苗的保护率越高资料来源:Hector S Izurieta, Yoganand Chillarige, Jeffrey Kelman, Yuqin Wei, Yun Lu, Wenjie Xu, Michael Lu, Douglas Pratt, Steve Chu, Michael Wernecke, Thomas MaCurdy, Richard Forshee, Relative Effectiveness of Cell-Cultured and Egg-Based Influenza Vaccines Among Elderly Persons in the United States, 2017–2018, The Journal of Infectious Diseases, Volume 220, Issue 8, 15 October 2019, Pages 1255–1264,中金公司研究部
图表20:2018-2019年流感季,针对流感相关住院的流感疫苗相对有效性

注:RVE,相对疫苗保护率,即相对参考队列的疫苗保护率,值越大代表相对参考疫苗的保护率越高
资料来源:Hector S Izurieta, Yoganand Chillarige, Jeffrey Kelman, Yuqin Wei, Yun Lu, Wenjie Xu, Michael Lu, Douglas Pratt, Michael Wernecke, Thomas MaCurdy, Richard Forshee, Relative Effectiveness of Influenza Vaccines Among the United States Elderly, 2018–2019, The Journal of Infectious Diseases, Volume 222, Issue 2, 15 July 2020, Pages 278–287,中金公司研究部
图表21:Flucelvax细胞培养三价流感疫苗安全性数据

注:ccIIV3: cell-based trivalent inactivated influenza vaccine; CI: Confidence interval; IIV3: trivalent inactivated influenza vaccine; RR: Risk ratio 资料来源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
Fluad佐剂流感疫苗:保护力优于标准疫苗,安全性尚可
Fluad佐剂流感疫苗预防效力略高于标准疫苗,安全性尚可。Fluad是诺华生产的含创新佐剂MF59的亚单位流感疫苗,于1997年在意大利首次获得批准,随后于2015年在美国和欧洲获得批准,用于65岁及以上人群。此外,Fluad四价流感疫苗也已被批准用于该老年人群,并在美国2020-2021年季节上市。MF59 是一种水包油的乳剂,包含1%鲨烯,0.5%吐温80和0.5%三油酸聚山梨脂的水包油乳液,可明显增强疫苗诱导的体液免疫,也可诱导产生一定的Th1/2型细胞免疫。
得益于MF59佐剂,Fluad佐剂流感疫苗可提供较强的保护力,美国CDC指出该疫苗在65岁及以上人群的保护效力优于标准疫苗,但该疫苗的接种后不良反应也明显多于标准疫苗。值得注意的是,Fluad仍采用鸡胚培养技术,未能克服此类疫苗对H3N2预防效力较低的缺点。
图表22:Fluad佐剂三价流感疫苗有效率数据

注:aIIV3: adjuvanted trivalent inactivated influenza vaccine; CI: Confidence interval 资料来源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
图表23:Fluad佐剂三价流感疫苗安全性数据

注:aIIV3: adjuvanted trivalent inactivated influenza vaccine; CI: Confidence interval; IIV3: trivalent inactivated influenza vaccine; RR: Risk ratio 资料来源:O Murchu E, Comber L, Jordan K, Hawkshaw S, Marshall L, O'Neill M, Ryan M, Teljeur C, Carnahan A, Pérez JJ, Robertson AH, Johansen K, Jonge J, Krause T, Nicolay N, Nohynek H, Pavlopoulou I, Pebody R, Penttinen P, Soler-Soneira M, Wichmann O, Harrington P. Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Rev Med Virol. 2023 May;33(3):e2329.,中金公司研究部
下一代流感疫苗:mRNA和通用流感疫苗持续探索中
现有流感疫苗接种保护效率仅为40-60%,特别当疫苗毒株和流行毒株不匹配时,疫苗有效性将进一步降低。针对这一问题,更多疫苗厂商开始探索应用新技术开发更多创新疫苗,其中mRNA疫苗与通用疫苗在近年取得了一定进展。
► mRNA技术在新冠疫情展示出技术优势,其研发周期短、规模化生产效率高且避免病毒传代培养的适应性突变等诸多优势理论上非常契合流感病毒疫苗的设计要求;目前Moderna旗下的成分改良版mRNA-1010已展示较为积极的III期临床结果,尽管其披露数据未在临床层面显示相对灭活流感疫苗的明显优势,但预计其有望通过快速生产制备优势和多联苗潜力切入市场。
► 通用流感疫苗是指可对多种流感病毒株均可产生持久保护性的通用流感疫苗,其主要难点在于抗原靶点的选择,以及对抗原效力的评估,此类疫苗开发并不拘泥于特定技术路线,灭活/重组蛋白/mRNA/腺病毒均具备开发潜力;截至2023年12月,全球已有192款候选通用流感疫苗,其中临床阶段有38款,III期临床阶段有6款。
中金研究认为mRNA流感疫苗有望率先实现商业化,建议关注mRNA-1010的后续上市申报及商业化进度,以及其他mRNA流感疫苗的开发进展;通用流感疫苗仍在寻找合适的抗原靶点,建议关注临床阶段产品对抗原位点的概念性验证。
mRNA流感疫苗:对乙型流感反应低是行业性难题,安全性有待优化
Moderna和辉瑞/BioNTech拥有先发优势,老牌疫苗企业抓紧追赶。率先开发出mRNA疫苗的Moderna和辉瑞/BioNTech均将mRNA流感疫苗作为了传染病疫苗管线中重点布局方向之一,且均已披露了较为积极的III期临床数据;此外,葛兰素史克、CSL Seqirus和赛诺菲等一众流感疫苗企业也先后布局了mRNA流感疫苗。
理论上,mRNA流感疫苗企业只需流感病毒的基因序列,就可以快速、大规模生产出有效性较强的流感疫苗,最大可能降低WHO预测不准的负面影响。但从商业化角度分析,不同于新冠疫苗市场的完全空白,流感疫苗市场已有稳定的产品和推广渠道,mRNA流感疫苗需要差异化策略才有望挑战当前流感疫苗的稳定地位,其可通过技术迭代获得更具优势的疫苗保护效力,亦可通过与其他疫苗联合制备成多联疫苗,从接种便利性的角度打开市场。
mRNA-1010 (Moderna):成分改良版流感疫苗III期结果积极
mRNA-1010是由Moderna开发的四价季节性流感mRNA候选疫苗,与主流流感疫苗类似,mRNA-1010靶向甲型流感病毒株H1N1/H3N2与乙型流感病毒株Yamagata/Victoria。此前公布的P301和P302两项临床中,对比标准灭活疫苗,mRNA-1010对甲流的抗体效价达到优效,但对乙流未达成非劣效性。随后Moderna对mRNA-1010进行了配方更新,2023年9月Moderna公告该版本mRNA-1010的III期临床P303的中期数据结果,达到主要临床终点:对比流感灭活疫苗Fluarix,mRNA-1010对四种流感亚型A/H1N1、A/H3N2、B/Yamagata、B/Victoria的HAI滴度更高。在另一项头对头I/II期临床中,对比赛诺菲Fluzone高剂量疫苗,mRNA-1010对A/H1N1、A/H3N2、B/Victoria达到了更高的HAI滴度,对B/Yamagata的HAI则较为接近;安全性方面,mRNA-1010的不良反应主要以1/2级为主,但发生率略高于标准流感疫苗。据公司公告,Moderna已与FDA就mRNA-1010上市展开沟通,预计该产品最快于2024年获批上市。
除mRNA-1010外,Moderna还在应用更多策略推进mRNA流感疫苗的研发,例如通过增加额外的HA抗原来提高对于甲流病毒的覆盖度(mRNA-1011和mRNA-1012),或增加HA和NA抗原来减少病毒免疫逃逸的可能性(mRNA-1020和mRNA-1030)等,中金研究建议关注更多mRNA流感疫苗的开发进展。
图表24:P303临床:mRNA-1010相较标准流感疫苗的GMT比值

资料来源:Moderna公告,中金公司研究部
图表25:P303临床:mRNA-1010相较Fluzone高剂量流感疫苗的GMT比值

资料来源:Moderna公告,中金公司研究部
图表26:P303临床:mRNA-1010安全性数据

资料来源:Moderna公告,中金公司研究部
modFlu (辉瑞/BioNTech):对乙型流感病毒的低反应性仍待改善
modFlu是由辉瑞和BioNTech共同开发的第一代mRNA流感疫苗。与mRNA-1010类似,modFlu靶向甲型流感病毒株H1N1和H3N2,和乙型流感病毒株Yamagata和Victoria。2023年11月辉瑞公布了modFlu在18-64岁人群中的III期临床结果,达到两项主要临床终点:主要临床终点采用流感病例的比例,modFlu不亚于标准流感疫苗,且流感季结束时进一步分析发现modFlu的有效性维持非劣于对照疫苗,但值得注意的是该流感季确证的流感病毒感染均未甲型流感;次要终点采用免疫原性分析,modFul仅针对甲型流感病毒达到终点,对乙型流感病毒未达到,两个临床终点均提示modFlu对乙型流感的预防效力较差。安全性方面,modFlu在18-64岁人群的安全性特征与标准流感疫苗类似。
据公司公告,BioNTech计划将于近期公布modFlu在老年人群的III期临床数据。此外,辉瑞/BioNTech也在开发流感+新冠二合一疫苗(I/II期数据积极,公司计划于未来数月内将开展III期临床)、流感+RSV二合一疫苗(I期)以及流感+新冠+RSV三合一疫苗(临床前)等更多新型流感疫苗。
图表27:modFlu在18-64岁人群的III期数据

注:1. Primary and end of season analyses considered both influenza A and B cases collectively, though the vast majority of cases recorded in this trial, and during the 2022 / 2023 influenza season overall, were influenza A cases; 2. Superiority vs. the licensed influenza comparator not met at end of season analysis; Ph: Phase 资料来源:辉瑞官网,中金公司研究部
SP0273 (赛诺菲):放弃初代mRNA流感疫苗研发
流感mRNA疫苗SP0273是赛诺菲重金收购Translate Bio后的核心项目之一。2021年8月,赛诺菲斥资32亿美元收购mRNA疫苗公司Translate Bio,收购后重点推进mRNA四价流感疫苗SP0273的研发。2023年6月,赛诺菲在疫苗投资者日公布了SP0273的I/II期数据(非与mRNA-101头对头临床),跨研究对比,数据与Moderna的初代mRNA-1010类似,对甲流的保护效力良好,但对乙流表现不佳;安全性方面,SP0273劣于主流灭活流感疫苗,但优于mRNA-1010。由于SP0273的临床数据不佳,赛诺菲已停止初代mRNA流感疫苗开发,并积极通过AI优化抗原设计和毒株选择,以强化疫苗对乙流的免疫响应。
图表28:SP0273的有效性数据
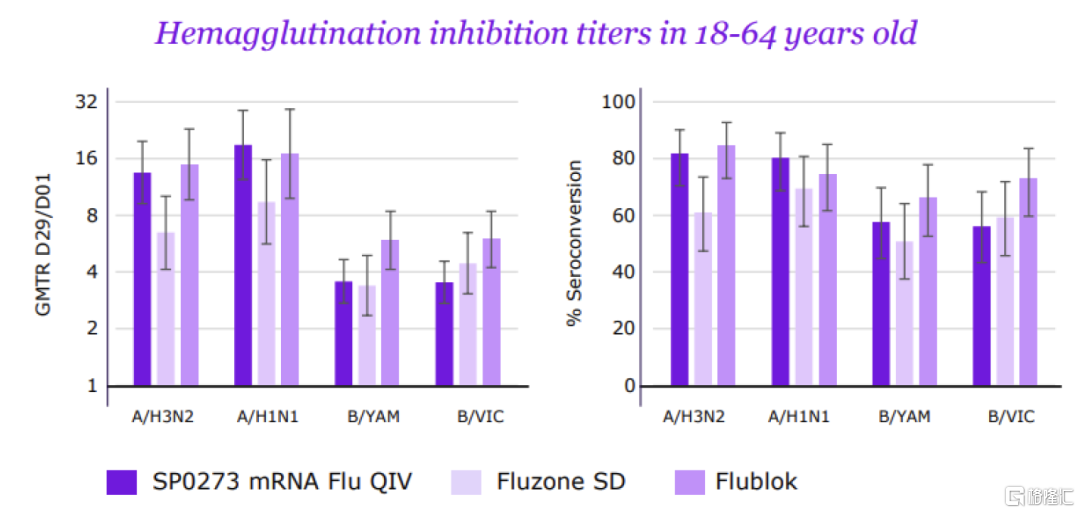
资料来源:赛诺菲官网,中金公司研究部
图表29:SP0273的安全性数据

资料来源:赛诺菲官网,中金公司研究部
通用流感疫苗:流感疫苗理想形态,抗原筛选是主要难题
理想的通用流感疫苗可提供针对所有流感毒株的长期免疫。传统流感疫苗的抗原主要采用血凝素(HA)的头部区域,该部分最容易成为免疫系统的攻击目标,但该区域结构不稳定,相关基因容易发生突变,造成流感疫苗对新的病毒亚型几乎没有保护作用。基于新型疫苗平台的通用流感候选疫苗大多针对保守抗原,如M2e、HA stem、NP和M1,旨在诱导强交叉保护抗体反应和强交叉反应T细胞反应,以实现对所有流感病毒亚型的预防保护效果。根据盖茨通用流感疫苗基金会,截至2023年12月,全球已有192款、包括6种疫苗开发平台的候选通用流感疫苗在研,其中临床阶段有38款,III期临床阶段有6款。
图表30:全球通用流感疫苗进度(II/III期,截至2023年底)

资料来源:盖茨通用流感疫苗基金会,中金公司研究部
较容易结合的血凝素(HA)的保守区域(茎部)是目前通用流感疫苗的主要方向。与高变异性的 HA 头部相比,HA 茎部以及新的靶点NA、M2e和NP,具有更高的保守性,更有通用疫苗研究的潜力。理论上各类疫苗平台均具备开发出通用流感疫苗的潜力,但目前尚未有较为积极的数据读出,中金研究建议关注临床阶段产品对抗原位点的概念性验证。
国内市场展望:灭活流感疫苗仍是主要路线,新型流感疫苗处于对标追赶阶段
中国流感疫苗技术路线趋同,存在迭代空间
除百克生物外,国内上市流感疫苗均采用传统灭活裂解技术。1996年,赛诺菲引入国内第一支流感疫苗;同一时期,国家优化疫苗行业准入的行政管制,加速民营疫苗企业的成立和发展。面对海外发展成熟的灭活流感疫苗技术路线,国内厂商直接采用Follow策略开发国产流感疫苗,明显加速了国产流感疫苗的上市。经过20多年的发展,国内大部分疫苗厂商已具备了灭活流感疫苗技术,大部分疫苗厂商也将流感疫苗作为管线布局之一,导致了国内流感疫苗行业陷入同质化竞争。截至2023年12月,中国已经批准上市的流感疫苗以灭活流感疫苗为主,其中三价苗15款,四价苗10款。
► 三价流感疫苗:三价苗由于上市时间较早,国内拥有产能和生产文号的疫苗企业众多,其中代表性企业包括科兴生物、长春所、华兰疫苗和赛诺菲等。2018年疫苗行业安全性事件导致三价流感疫苗供给明显下滑,除此外之外行业整体供应量保持稳定提升。但由于四价苗自2018年快速放量,三价苗的市场率市占率明显下滑,2018年、2020年和2022年其批签发量市场率分别为57%、46%和32%。近些年行业细分格局有所调整,华兰疫苗、长春所等企业将业务重心转移至四价流感疫苗,导致其市场份额下滑,而科兴、赛诺菲等企业市场份额不断提升。
► 四价流感疫苗:四价苗上市时间较晚,2018年华兰疫苗推出国内首个产品,但随后行业以每年增加1-2款产品的速度持续扩容,目前代表性企业包括华兰疫苗、金迪克等。2018年起华兰疫苗旗下四价苗拉动国内流感疫苗市场扩容,据中检院批签发数据,四价苗的市场占比快速提高,2023年四价苗的市占率已爬升至75%。近些年随着更多企业涌入四价流感疫苗市场,头部企业的市占率出现逐步下滑的趋势。
图表31:国内流感疫苗批签发次数(2016-2023)

资料来源:中检院,中金公司研究部
图表32:中国流感疫苗批签发数量(2017-2021)

资料来源:各公司公告,中金公司研究部
图表33:流感疫苗市占率(按批签发量计算)
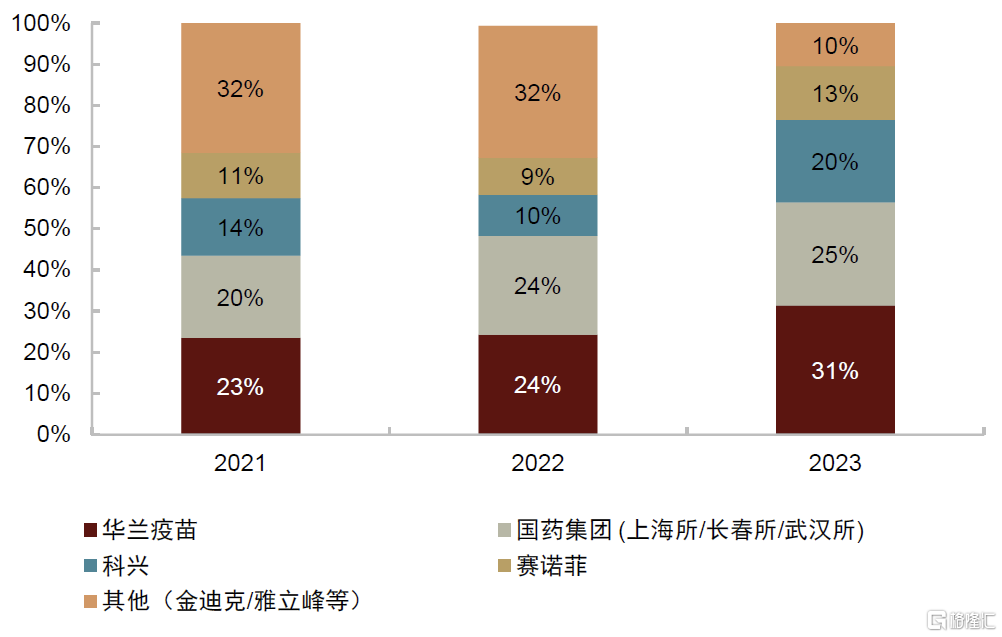
资料来源:IQVIA,中检院,中金公司研究部
图表34:国内上市流感疫苗竞争格局(截至2023年12月)

资料来源:药智网,中国流感疫苗预防接种技术指南(2022-2023),中金公司研究部
多款流感疫苗处于在研阶段。根据CDE和Insight数据库,国内在研四价流感疫苗以灭活路线为主,其中进度居前的智飞龙科马(智飞生物全资子公司)、雅立峰生物(复星医药全资子公司)、浙江天元(步长制药子公司)生产注册已获受理;康润生物、康泰生物、成大生物均处于III期临床阶段。创新路线方面,公司已有5家企业的四价流感疫苗(MDCK细胞)进入临床阶段。
图表35:国内在研流感疫苗竞争格局(截至2023年12月)

资料来源:Insight,CDE,中金公司研究部
国内流感疫苗接种率拥有较大提升空间
得益于支付体系完善、居民接种意识高以及接种场所灵活,美国流感接种率长期较高。据美国CDC,2021-2022年美国6月龄及以上人口接种率为51.4%,其中儿童/青少年和老年人接种率均超过65%。ACIP自2010年起大力推荐接种流感疫苗,此外完善支付能力、群众接种意识和接种场所灵活构成美国流感疫苗接种率较高的主要原因:1)支付能力上,美国商保、Medicare等保险全面覆盖流感疫苗,超3/4的民众可免费接种;2)接种意识上,经过多年教育,美国民众对流感疫苗接种的必要性和重要性认知较高;3)接种便利性上,美国可在各大药房、医院诊所、医务室甚至流动疫苗车接种流感疫苗,且可自由选择工作日/上学日前往接种。
图表36:美国6个月至17岁儿童流感疫苗接种率

资料来源:美国疾病预防控制中心,中金公司研究部
图表37:美国18岁及以上成年人流感疫苗接种率

资料来源:美国疾病预防控制中心,中金公司研究部
受限于自费支付政策、居民接种意识不足以及疫苗可及性不佳,国内流感疫苗接种率有明显提升空间。据2022年全国疫苗和健康大会和疾控中心数据,2020-21年、2021-22年和2022-23年流感季,国内全人群流感疫苗接种分别为3.34%、2.47%和3.84%。国内流感疫苗接种率较低受多方面影响:1)大众对流感的危害和流感疫苗的预防作用认识不足;2)流感疫苗自费政策限制了部分人群接种积极性;3)流感疫苗可及性不足,例如部分接种点供不应求。预计随着各地陆续推出流感疫苗免费接种方案,以及各企业加大流感疫苗教育推广进度,国内流感疫苗接种率有望逐步提升。
图表38:免费接种和医保报销政策下人群流感疫苗接种情况(2020-2021和2021-2022年度流感流行季)

注:1)包括医务人员、重大活动保障人员、公安干警、教师、养老幼托机构工作人员等;2)包括学龄前儿童、中小学学生、老年人、监管人员、医务人员、机关单位工作人员等参保人及其亲属,未对医保报销政策的覆盖人群未进行分类调查;3)2个年度流感流行季分别为2020年9月-2021年1月;2021年10月-2022年3月。 资料来源:赵宏婷, 彭质斌, 倪兆林, 等. 2020—2021和2021—2022年度流感流行季我国流感疫苗接种政策和接种情况调查 [J] . 中华预防医学杂志, 2022, 56(11) : 1560-1564. DOI: 10.3760/cma.j.cn112150-20220810-00802.,中金公司研究部
近年新冠流感疫情中断国内流感疫苗放量提升节奏,疫后放量正逐步恢复。据金迪克公告,2018年四价流感疫苗上市同时国家鼓励重点人群接种流感疫苗,带动国内疫苗接种率快速提升,2020-21年流感季全国流感疫苗接种量接近5,000万支,对应接种率为3.34%;2021年初疾控中心预测2021-22流感季全国流感疫苗的潜在需求量约为8,907万支(8,352-9,473万支),行业内当年生产批签发超7千万支,但由于疾控资源主要倾斜给新冠疫苗接种,实际流感疫苗接种量低于上一年度,对应接种率仅为2.47%。2022-23年流感季生产批签发继续维持高位,2022年冬季国内新冠爆发导致流感疫苗接种继续下滑,但2023年初国内甲流流行拉动接种明显恢复,据疾控中心数据,2022-23年流感季接种率恢复至3.84%。2023-24年流感季国内各地出现不同程度的流感高水平活动,预计或进一步利好流感疫苗的终端放量。
中性假设下,预计国内流感疫苗市场规模有望达到110亿元,对应全人口接种率约9%。中国疾病预防控制中心重点推进老年人及儿童等易感人群接种流感疫苗,预计未来仍将延续儿童和老年人流感疫苗市场占据主要份额的趋势。中性假设下,预计各年龄组流感疫苗接种率相较2020-21年流感季增加一倍,疫苗平均价格下滑到80-90元/剂,则国内流感疫苗市场规模为110亿元。值得注意的是,该假设暂未考虑潜在新型流感疫苗的贡献,参考海外新型流感疫苗定价往往高于标准流感疫苗,中金研究认为未来新型流感疫苗有望进一步提高国内流感疫苗的市场规模的天花板。
图表39:中国流感疫苗市场规模预测

注:人口数据根据21年人口普查测算 资料来源:国家统计局,中金公司研究部
风险
► 疫苗安全性问题:国内各监管部门对疫苗产品质量强监管,如果公司产品出现安全性问题,可能导致产品停产或者退市。
► 疫苗研发进度不及预期:疫苗研发涉及I/II/III期临床,对疫苗的安全性、有效性、GMP生产提出较高要求,若某一环节受阻,可能导致疫苗研发进度推迟。
注:本文摘自中金研究2024年1月17日已经发布的《疫苗行业系列报告:创新流感疫苗重塑海外竞争格局》,分析师: 邹 朋 S0080513090001 ;郑航慈 S0080522080007; 杨一正 S0080523100002
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



