创新药物研发,作为医药科技领域的核心驱动力,始终处于不断演进与突破的前沿。据药融云获悉,全球创新药研发领域本周(2024.4.1-4.7)动态丰富:卫材与渤健合作的阿尔茨海默病治疗方案已提交监管审批;Vistagen启动其鼻喷剂制剂fasedienol的三期临床研究;第一三共与阿斯利康联手研发的抗体偶联药物(ADC)获美国食品药品监督管理局(FDA)加速批准;默沙东KRAS抑制剂联合Keytruda启动3期临床....
1.卫材/渤健阿尔茨海默病疗法递交监管申请
近期,卫材和渤健宣布,卫材已向美国FDA提交了每月一次使用Leqembi(lecanemab)作为维持治疗的补充生物制品许可申请(sBLA),用于治疗阿尔茨海默病(AD)患者的轻度认知障碍或轻度痴呆阶段的疾病(统称为早期AD)。
阿尔茨海默病(Alzheimer,sDisease,AD)又称老年性痴呆,是老年期痴呆最常见的一种类型,以进行性发展的神经系统变性为特征,是老年人失能和死亡的主要原因,其病理特征是黑质DA能神经元变性缺失和路易小体形成。根据国际阿尔茨海默病协会的报告显示,每隔3秒,全世界就会多一位阿尔茨海默病(AD)患者。
Leqembi是一款靶向Aβ蛋白的单克隆抗体,已经在美国、中国和日本获得监管机构的批准上市,并且在全球多个国家和地区接受监管机构的审评。作为维持治疗的一部分,完成了每两周一次Leqembi起始治疗阶段的患者,将接受每月一次静脉输注的Leqembi维持治疗,以维持有效的药物浓度,持续清除具高度毒性的原纤维蛋白。卫材表示,已经递交针对Leqembi皮下注射剂型的快速通道资格申请,在获得快速通道资格后将启动sBLA的滚动提交,寻求批准Leqembi皮下注射剂型作为维持疗法。
Leqembi药物基本信息
 截图来源:药融云全球药物研发数据库
截图来源:药融云全球药物研发数据库
根据WH0报道,目前全球痴呆症患者已超5500万,其中阿尔兹海默病患者的占比约60%-70%,对应人群在3300-3850万。目前中国已有1000万阿尔兹海默病患者,约占世界总患者数的1/3,且人数将随着老龄化加重进一步提升。并且,根据《中国阿尔兹海默病报告2021》,2015年我国由于阿尔兹海默病疾病产生的医疗费用支出已超1.2万亿元,且将在2050年超过13万亿元,成为一笔庞大的开支费用。
据药融云数据库显示,目前国内布局阿尔兹海默病赛道的药企有:绿叶制药、天士力、东阳光、再鼎医药、恒瑞、康缘药业等多家知名药企。阿尔兹海默病赛道的研发热情已被重新点燃。
2.Vistagen鼻喷剂fasedienol3期临床启动,用于社交焦虑症
近期,Vistagen宣布启动PALISADE-3临床3期试验,该试验评估其在研fasedienol(PH94B)鼻喷剂用于急性治疗社交焦虑症(SAD)成人患者的疗效与安全性。
社交焦虑症、社交焦虑障碍( social anxiety disorder,SAD)又称社交恐惧症( social phobia)是以在社交场合持续紧张或恐惧,回避社交行为为主要临床表现的一类焦虑恐惧障碍。
社交焦虑症的核心症状是显著而持续地担心在公众面前可能出现丢丑或有尴尬的表现,担心别人会嘲笑、负性评价自己,在别人有意或无意的注视下,患者就更加拘束、紧张不安,因此常常回避社交行为。在极端情形下可导致自我社会隔离,对必须即将参加的社交充满紧张不安,这些恐惧可能影响功能或引起明显的痛苦,还可能会伴发躯体症状,如脸红、心跳加快、口干舌燥、吞咽困难、全身颤抖或肌肉抽搐、出汗等症状。
Vistagen的Fasedienol是一种潜在“first-in-class"快速起效的在研鼻喷雾剂,具新颖的作用机制,可调节与恐惧和焦虑密切相关的嗅觉-杏仁核神经回路,减弱交感神经自主神经系统的张力。Vistagen计划在2024年下半年启动另一项相同的3期临床试验PALISADE-4,以推动fasedienol成为首个SAD疗法。
社交焦虑症的单药治疗中,选择性5-羟色胺再摄取抑制剂(SSRI)是社交恐惧症药物治疗中研究最充分且最常用的药物,其中帕罗西汀是美国FDA批准用于社交恐惧症的首个药物。据药融云数据库显示,2019年帕罗西汀院内销售额近11亿,2020年有所下降但后续销售额逐年上升。
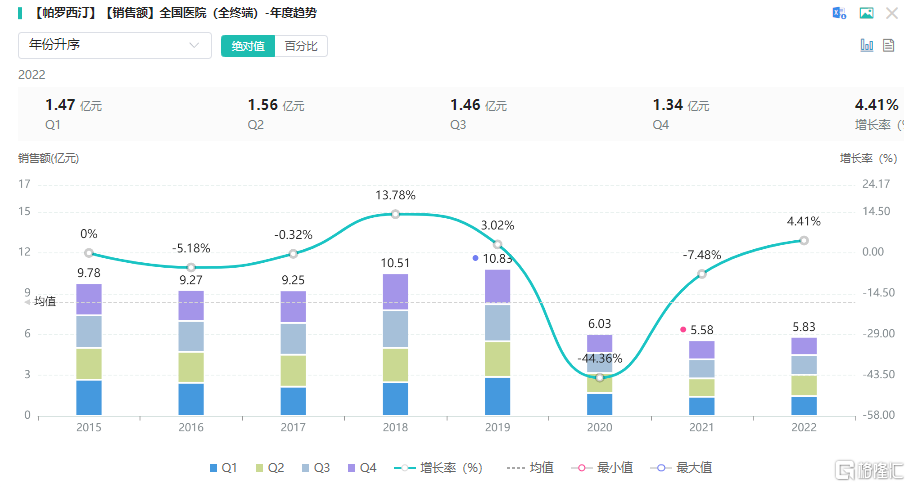
目前国内布局帕罗西汀的公司有:浙江尖峰药业、北京福元医药、浙江华海药业、江苏睿实生物、华益泰康药业等多家药企。
3.第一三共和阿斯利康联合开发ADC获FDA加速批准
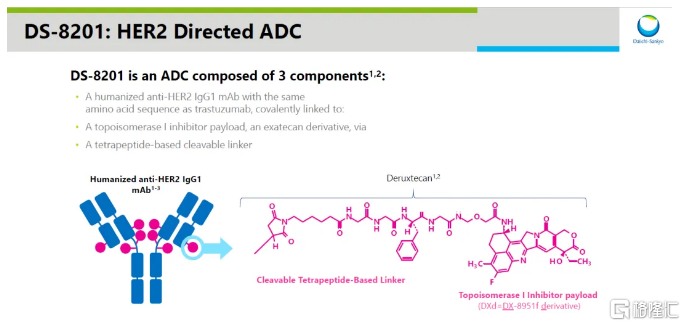
近期,美国FDA宣布加速批准由第一三共(DaiichiSankyo)和阿斯利康(AstraZeneca)联合开发的重磅抗体偶联药物(ADC)Enhertu(trastuzumabderuxtecan)用于治疗不可切除或转移性HER2阳性(免疫组化[IHC]3+)实体瘤成年患者,这些患者已接受过先前治疗且缺乏满意的替代治疗选项。
之前新闻稿指出,Enhertu是首款具有不限癌种适应症的HER2靶向ADC疗法,它采用第一三共专有的DXdADC技术平台设计,由靶向HER2的人源化单克隆抗体通过四肽可裂解连接子,与拓扑异构酶1抑制剂有效载荷连接组成。值得注意的是,这项批准对于罹患HER2阳性罕见癌症的患者尤为重要,因为专门针对这些患者进行临床试验的机会较为有限。
这次批准主要基于在192名经治、不可切除或转移性HER2阳性(IHC 3+)实体瘤成人患者中的疗效评估结果,这些患者参加以下三项多中心试验之一:DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02。所有三项试验皆排除有间质性肺病(ILD)或需要类固醇治疗肺炎病史的患者,或者在筛选时患有ILD、肺炎或临床上显著心脏疾病的患者。试验还排除了具有活动性脑转移或ECOG体能状态>1的患者。入组患者持续接受治疗,直至病情进展、死亡、撤回同意或出现不可接受的毒性。
除了共同开发Enhertu,阿斯利康和第一三共也共同开发Trop2靶向ADC datopotamab deruxtecan(Dato-DXd)。第一三共也在去年10月与默沙东(MSD)就该公司的三个ADC候选药物:patritumab deruxtecan(HER3-DXd)、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)达成了全球开发和商业化协议,将在全球范围内共同开发和潜在商业化这些候选ADC疗法。
4.默沙东KRAS抑制剂联合Keytruda启动3期临床
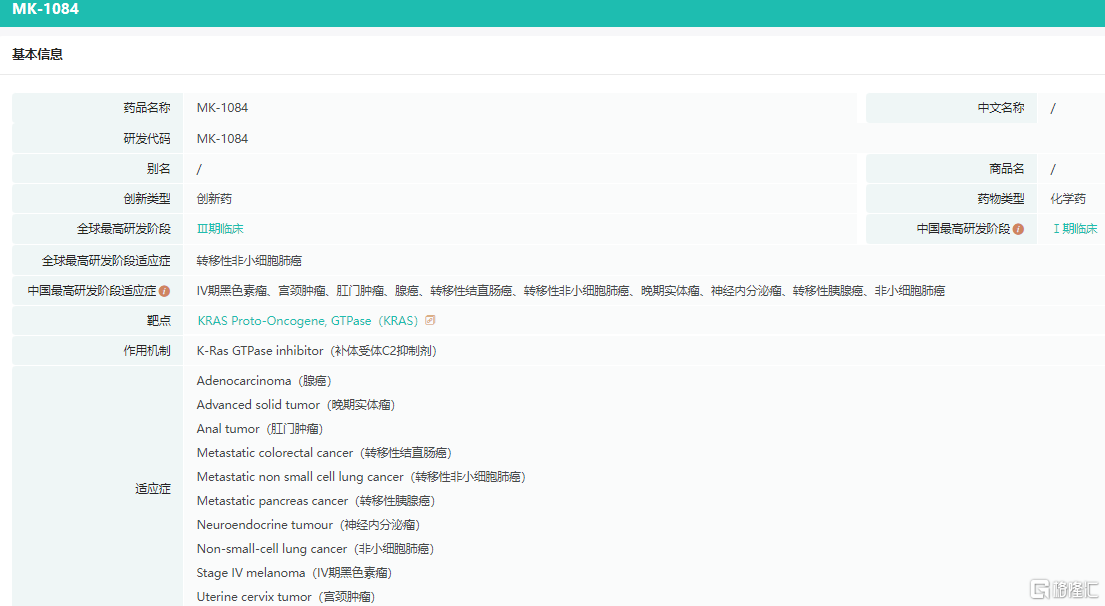
近期,默沙东宣布已经启动了一项3期临床试验,使用在研口服选择性KRASG12C抑制剂MK1084,与重磅PD-1抑制剂Keytruda联用,一线治疗携带KRASG12C突变且高度表达PD-L1(肿瘤比例评分[TPS]≥50%)的转移性非小细胞肺癌(NSCLC)患者。该试验将在全球范围内招募约600名患者。研究的主要终点是无进展生存期和总生存期,关键次要终点包括客观缓解率和缓解持续时间。
MK-1084是一种特异性KRAS G12C共价抑制剂。KRAS的突变是在癌症中发现的最普遍的突变之一,在非小细胞肺癌、胰腺癌、泌尿生殖癌和结直肠癌中高频发生。KRAS G12C突变是患者中最常见的KRAS突变,约占非小细胞肺癌(腺癌)的14%。MK-1084由默沙东与Taiho Pharmaceutical和Astex Pharmaceuticals合作开发。
MK-1084药物基本信息
综上所述,全球创新药研发舞台活跃非凡,各大药企积极布局并取得显著进展。从阿尔茨海默病疗法的申报审批,到新型鼻喷剂制剂进入关键性临床试验,再到抗体偶联药物与CAR-T疗法接连赢得FDA加速批准或再批准,这些成果不仅彰显了科研创新的力量,也预示着未来治疗方案的多样性和个性化趋势,为患者带来更多希望,有力推动全球医药健康产业的持续发展与进步。
<END>
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员