今年以来,国产鼻咽癌新药有了不少突破。
10月27日,君实生物的特瑞普利单抗成为国产首个成功闯关FDA的PD-1单抗,并且是FDA批准的首个鼻咽癌治疗药物。
12月2日,康方生物自研的派安普利单抗联合化疗一线治疗复发或转移鼻咽癌的新药上市申请获得NMPA受理。
除PD-1单抗外,被称为抗癌“魔法子弹”的ADC也取得了突破性进展。
乐普生物自研的EGFR ADC产品MRG003于12月4日获FDA授予快速通道认定,用于治疗复发或转移鼻咽癌。此前,MRG003还就该适应症获得了中美突破性疗法双重认定。
有意思的是,国产药企不仅打开了鼻咽癌免疫治疗的新布局,还诠释了“小适应症先行”的商业化“阳谋”。
一、鼻咽癌:“中国特色”肿瘤,治疗方案不断优化
鼻咽癌(NPC)是我国常见的恶性肿瘤之一。
鼻咽癌指发生于鼻咽腔顶部和侧壁的恶性上皮肿瘤,具有高度侵袭性特性,患者初期大多会出现鼻塞、涕中带血、听力下降、头痛等症状。EB病毒感染、环境、饮食和遗传因素,都是鼻咽癌可能的病因。
全球大部分鼻咽癌患者新病例发生在东亚和东南亚,而中国是高发地,发病率高于西方,且以华南地区最为多见。据公开数据显示,2020年全球鼻咽癌新发病例达13.3万人,其中我国占据一半左右,且死亡病例数居全球首位。
但大多数鼻咽癌患者发现时已是中晚期,生存率仍然较低,且有少数患者伴有远处转移。
根据国家癌症中心统计数据,我国复发或转移鼻咽癌(R/M NPC)患者约占NPC病例总数的35%,且生存结果极差,中位生存期(OS)约为20个月,仍有大量尚未被满足的临床需求。
不过,由于医保简易续约规则的缘故,创新药企普遍采取小适应症先上市的“抢跑”策略。这就使得鼻咽癌往往成为药企最先拿下商业化的小适应症。
根据安信证券研报显示,以往多数企业倾向于小适应症先进医保以加速进院速度,抢先占据市场,然后再将后续获批的大适应症逐渐纳入医保。
但是,按照当前简易续约规则,小适应症先进医保需要大幅降价,后续再新增大适应症时同样需要重新谈判(无明确规则降幅不可控),此背景下小适应症先不进医保等大适应症获批后同时进医保以控制总体降幅可能为优选策略。尤其对商业化能力较强的企业,小适应症获批后不进医保可能对其进院速度影响较小。
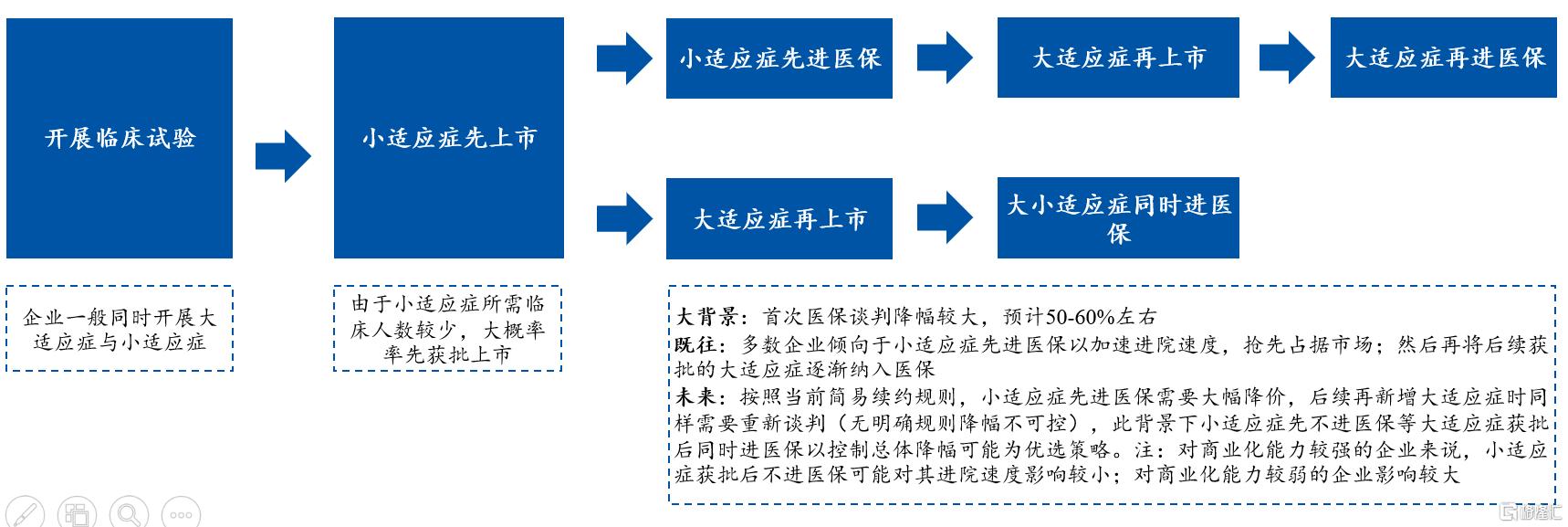
国内创新药研发、上市、进医保趋势 资料来源:医保局,安信证券研究中心
另外,随着医学的不断发展,鼻咽癌的治疗方案也在不断优化
手术治疗、放疗和化疗等传统治疗方式是鼻咽癌治疗手段之一。CSCO和NCCN指南均推荐吉西他滨+顺铂化疗(GP方案)为R/M NPC一线治疗首选方案。
而接受放疗后仍出现复发或远处转移的晚期NPC患者,则需要接受新的治疗方案。
临床研究表明,PD-1/PD-L1单抗可通过单药或联合化疗提高鼻咽癌患者疗效及生存获益,尤其疗效更高的“PD-1单抗联合GP方案”正逐渐成为R/M NPC一线治疗的核心疗法。
此外,在R/M NPC治疗中显示良好抗肿瘤活性的新型ADC药物,也正在打开鼻咽癌免疫治疗的新布局。

二、PD-(L)1单抗成核心疗法,君实PD-1叩开FDA大门
针对预后较差的复发或转移鼻咽癌患者(R/M NPC),PD-1/PD-L1药物是目前较为有效的治疗方案。
据Insight数据库显示,全球仅有3款PD-1单抗新药获批用于治疗R/M NPC,分别为恒瑞医药的卡瑞利珠单抗、君实生物的特瑞普利单抗和百济神州的替雷利珠单抗。
综合国内外药企披露的临床研究结果,PD-1单药治疗鼻咽癌的有效率为20%-30%,而联合化疗后疗效可大幅提高。
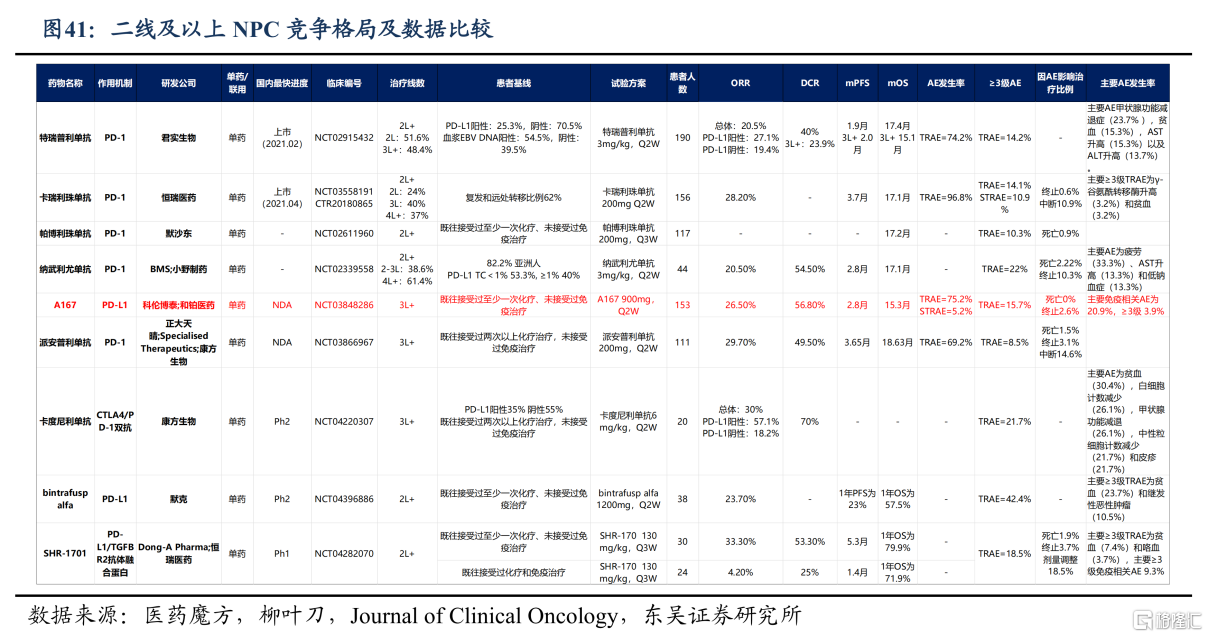
国内药企中,率先撞线一线治疗鼻咽癌的是“医药一哥”恒瑞医药。
2021年6月,NMPA基于III期临床试验(CAPTAIN-1ST研究)批准了卡瑞利珠单抗联合顺铂和吉西他滨(GP方案)一线治疗R/M NPC,且是全球首个获批的一线鼻咽癌适应症。
据CAPTAIN-1ST研究结果显示:卡瑞利珠单抗联合GP组的ORR为88.1%,中位PFS为10.8个月,安慰剂联合GP组的ORR为80.6%,中位PFS为6.9个月。
君实的特瑞普利单抗之所以能成功闯关FDA,正是基于取得亮眼数据的III期临床试验(JUPITER-02研究)。
根据JUPITER-02研究结果显示,特瑞普利单抗联合GP治疗组一线治疗R/M NPC的mPFS可达到21.4个月,较安慰剂组(即单纯化疗组)显著延长13.2个月,延长至近3倍,创造了患者生存获益的新高度,而且OS较安慰剂组显著提高(未达到vs33.7个月,P=0.0083),死亡风险下降了37%(HR=0.63),刷新了既往晚期NPC患者OS获益记录。
另外,特瑞普利单抗组的2年及3年OS率亦得到显著改善,分别达到78.0%和64.5%,而安慰剂组百分比为65.1%和49.2%,能给更多R/M NPC患者带来生存获益。
亮眼的数据,在商业化上得到了体现。2023年前三季度,特瑞普利单抗实现营收6.68亿元,同比增长约29.7%。
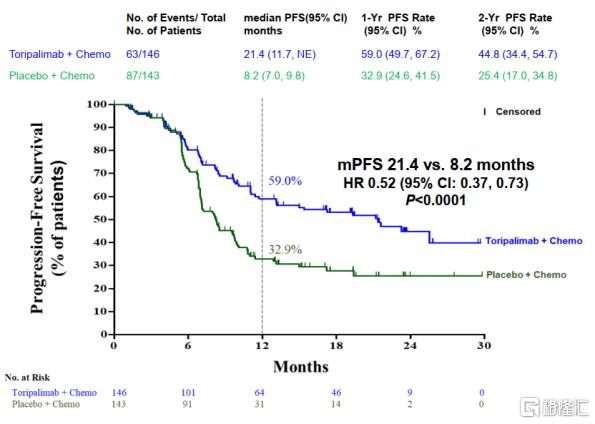
2022AACR大会JUPITER-02研究最终PFS分析数据
资料来源:中国医学论坛今日肿瘤
不久前,君实公布了特瑞普利单抗在美国的售价8892.03美元/瓶(约6.36万元人名币),相比默沙东的K药每三周使用费用11115.04美元便宜了20%。有机构预测,特瑞普利单抗在鼻咽癌适应症中销售峰值将达到2亿美金,并预计在2-3年达成。
在奔涌的后浪中,康方生物的派安普利单抗也即将撞线鼻咽癌适应症。
派安普利单抗(AK105)是目前唯一采用IgG1亚型并进行Fc段改造的新型差异化PD-1单抗,能够更有效增强免疫治疗疗效,且减少不良反应。而且,继提交三线治疗R/M NPC的上市申请后,派安普利单抗联合化疗一线治疗R/M NPC的上市申请已于12月4日获得NMPA受理,覆盖了NPC从1L到3L的治疗。

派安普利单抗研发情况 来源:康方生物官网
除PD-1外,PD-L1单抗也是鼻咽癌治疗的一大看点。
这是由于,PD-L1在约89%至95%的NPC肿瘤中高度表达,而且目前尚无获批用于治疗R/M NPC的PD-L1单抗,市场前景值得期待。
科伦博泰的A167(泰特利单抗)将有望成为国内首个针对鼻咽癌的PD-L1单抗。早在2021年11月,科伦博泰就向国家药监局递交了A167用于三线治疗R/M NPC的上市申请,预计于2023年底或2024年上半年获批上市。
此前,科伦博泰将A167的大中华区权益授予了和铂医药。截至2023年6月,和铂医药支付了600万美元的预付款和200万美元里程碑款项,预计里程碑款项最多可达到3.51亿美元。
三、双抗、ADC开辟鼻咽癌新疗法,乐普生物、百利天恒
作为主流技术的双抗、ADC,正在试图突破鼻咽癌的治疗。
例如,康方生物研发的PD-1/CTLA4双抗卡度尼利单抗,除了针对宫颈癌、肺癌、肝癌和胃癌等多个实体瘤以外,在三线治疗转移性鼻咽癌患者的研究中也显示出了初步疗效。
根据II期研究显示,截止2021年6月已入组23人,在20名可评估疗效的患者中,卡度尼利单抗的ORR达到30%,DCR为70%;PD-L1阳性患者ORR为57.1%。3级TRAEs发生率为21.7%,未发生4/5级TRAEs。
EGFR是癌症治疗的重要靶点,高度表达于结直肠癌、肺癌、头颈癌等多种恶性实体瘤中,89%的晚期鼻咽癌存在EGFR表达。
为此,乐普生物和百利天恒两家ADC新星都针对EGFR靶点开发了ADC药物,试图开辟鼻咽癌新疗法。
MRG003是乐普生物旗下子公司美雅珂研发的EGFR ADC,由抗EGFR的IgG单抗、可裂解肽键vc-PABC连接子和微管抑制剂MMAE组合而成,DAR值为4左右。其中,使用的EGFR单抗相比西妥昔单抗的结合亲和力提高约6-7倍,具有更好的内吞性。
根据MRG003针对二线或以上治疗R/M NPC的IIa期临床数据,2.0mg/kg剂量组ORR为39.3%,DCR为71.4%,mPFS为7.3个月;2.3mg/kg剂量组ORR为55.2%, DCR为86.2%,PFS数据尚不成熟。两个剂量组mDoR均为6.8个月。
凭借良好的疗效,MRG003获得了CDE突破性治疗药物认定、FDA孤儿药认定,以及FDA授予的快速通道认定,有望加速全球上市步伐。
作为国内进展最快的EGFR ADC管线之一,目前MRG003正在开展二线或以上治疗鼻咽癌、二线及以上治疗头颈癌的Ⅲ期关键临床试验,不出意外将成为国内首个获批的EGFR ADC,抢占市场机遇。
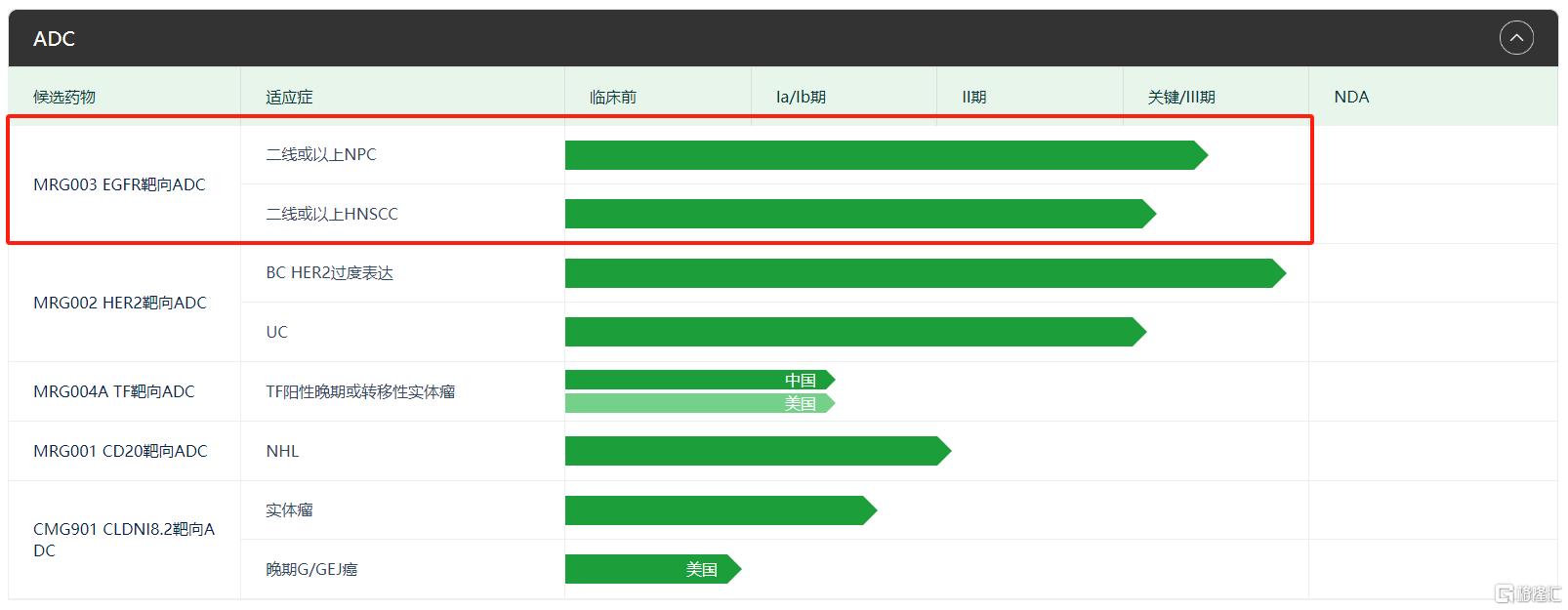
乐普生物的ADC研发管线 来源:公司官网
此外,鼻咽癌新疗法还出现了双抗ADC的身影,而且是全球首创的EGFR/HER3双抗ADC。
BL-B01D1是由百利天恒美国子公司Systimmune自研的EGFR/HER3双抗ADC,为全球第三个、中国首个进入临床的双抗ADC,也是全球首款且唯一进入临床的EGFR/HER3双抗ADC。
根据百利天恒在2023 ASCO年会上汇报的BL-B01D1针对多种重度经治的转移性/局部晚期实体肿瘤的首次人体I期数据。其中,对于鼻咽癌,ORR为45.8%,DCR为100%。10月31日,百利天恒启动了BL-B01D1针对鼻咽癌的III期临床试验。未来若顺利获批,将成为全球首个EGFR/HER3双抗ADC。
本周,百利天恒刚宣布以8亿美元首付款、潜在总价值最高达84亿美元,将BL-B01D1授权给BMS,刷新国产ADC新药出海授权新纪录。从中也能看出BMS对BL-B01D1的高预期。
四、结语
总结来看,从PD-1/PD-L1单抗到双抗,再到ADC甚至双抗ADC,鼻咽癌的治疗方案一直在不断优化、革新。
更有意思的是,无论“内卷之王”的PD-1,还是新一代差异化的ADC,都以鼻咽癌这一小适应症作为“抢跑”策略,冥冥中体现出创新药企的商业化“阳谋”。
参考资料:
1.各公司财报、公告、官网
2.《科伦博泰生物B-6990.HK-闪耀在全球ADC舞台上的创新Biotech》,东吴证券
3.《生物医药行业创新药研究框架之2023年医保谈判前瞻:续约政策持续优化,创新药长期放量可期》,安信证券
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



