为加速用于治疗严重和危及生命疾病的药物的开发和审查过程,美国FDA药物评估和研究中心(CDER)推行了一项利好政策——突破性疗法认定(Breakthrough Therapy Designation,BTD)。
这项政策的好处在于药物的开发过程可以得到FDA的深度参与和指导以及后续的上市申请有概率获得滚动审评和优先审评资格。
但BTD申请并不容易,需同时满足3个基本要求:
(1)相关的临床试验或研究性新药申请(IND)处于非临床暂停状态;
(2)适应症属于严重或危及生命的疾病;
(3)临床数据充分且足够完整,可以进行实质性审查。
在2017-2019年期间,FDA共收到了358份BTD申请,其中240份来自于非肿瘤药物。而在这240份申请中,仅39%(93/240)被FDA批准,余下61%(147/240)均被拒绝。在147份被拒绝的BTD申请中,61份因未满足申请基本要求被拒(例如适应症不属于严重或危及生命的疾病、招募患者与BTD适应症不匹配等),86份经审查后被拒。

2017-2019年FDA审查的240份非肿瘤药物BTD申请
批准的原因大同小异,可以总结为申请药物有明显的临床益处或安全性提高或其它方面改善。此外,这些药物大部分是基于II期(57%,53/93)或III期临床(16%,15/93)提交申请BTD,至少已开展一项随机临床试验(76%,71/93),并且这些随机临床多为盲法试验(82%,58/71)。
拒绝原因包括6种:①疗效不足(58%);②研究设计有缺陷(53%);③样本量过小或数据质量不过关(38%);④研究终点与疗效评价的相关性(33%);⑤安全性问题(16%);⑥事后分析结果充数(6%)。部分药物的BTD申请因多种原因被拒。

86份经审查BTD被拒绝的原因
此外,FDA也分析了BTD与治疗选择之间的联系,结果表明,针对无治疗选择的适应症的药物相对容易被授予BTD。在240份BTD申请中,107份涉及的适应症存在治疗选择,其中仅30份(28%)BTD申请获得批准;133份涉及的适应症不存在治疗选择,其中63份(47%)BTD申请获得批准。

240份非肿瘤药物BTD申请的后续情况
孤儿药相对容易被授予BTD。在240份BTD申请中,90份(42%)为孤儿药,其中47份(52%)获得批准,43份(48%)被拒绝。在余下的150份(58%)非孤儿药中,46份(31%)获得批准,104份(69%)被拒绝。这一现象也说明,FDA正在支持孤儿药的开发,未来孤儿药的应用范围有望扩大。
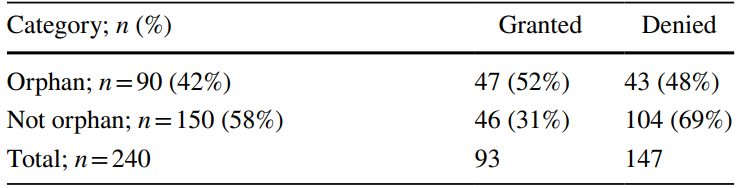
240份非肿瘤药物BTD申请的孤儿药状态
综合孤儿药状态和治疗选择状态进行分析后发现,无治疗选择的孤儿药相对容易被授予BTD(56% vs. 44%),而有治疗选择的非孤儿药相对较难被授予BTD(22.5% vs. 77.5%)。
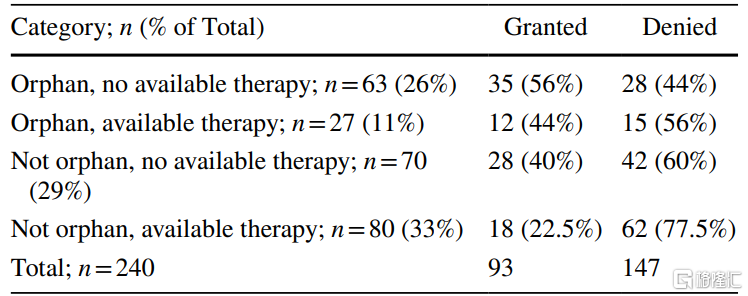 240份非肿瘤药物BTD申请的孤儿药&治疗选择状态
240份非肿瘤药物BTD申请的孤儿药&治疗选择状态
从这些结果可以看出来,明确的疾病指向性、确切的临床证据以及充分的研究设计是BTD申请获得批准的3大前提。不过,BTD并不是药物最终能够获批上市的指向灯。一款药物能否顺利从开发走向上市,还是要看各方面或各个阶段的工作能否做到尽善尽美。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



