在过去近两年的时间里,国产创新药海外授权纪录接连被打破。
先是2021年1月,百济神州将PD-1单抗替雷利珠单抗以交易总额22亿美元授权给诺华;半年后,荣昌生物将ADC药物维迪西妥单抗以交易总额26亿美元授权给Seagen,刷新了国内药企单品种海外授权的最高纪录。
之后仅过去四个月,百济神州再次将TIGIT抑制剂欧司珀利单抗授权给诺华,并以约29亿美元的交易总额再次打破纪录;前不久,康方生物将PD-1/VEGF双抗依沃西(AK112)授权给Summit Therapeutics公司,并以50亿美元交易总额刷爆国产创新药License out纪录。

国内药企 Licence out 总额超过 20 亿美元的重磅交易
截图来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
不难看出,近两年来国产创新药海外授权的药物品种呈现多样化,涵盖了PD-1单抗、ADC药物、TIGIT抑制剂和PD-1/VEGF双抗。
随着此次康方生物的PD-1/VEGF双抗打破国产创新药Licence out纪录,无疑让第二代免疫治疗药“双抗”又再一次获得关注。
一、第二代免疫治疗药,“双抗”成热门研发方向
众所周知,PD-1(免疫检查点抑制剂疗法)虽然开启了肿瘤的免疫治疗时代,但也不可避免存在缺陷,比如低响应率、单药疗效不足(大部分实体瘤有效率仅为20%-30%)、疾病持续缓解时间有限且副作用大等。
为此,全球药企掀起了PD-1单抗与其他药物联合治疗的研发热潮。比如,典型的PD-1抑制剂纳武利尤单抗(Opdivo,俗称O药)和CTLA-4抑制剂伊匹木单抗(Yervoy,俗称Y药)的联合疗法。
由于“O药+Y药双重免疫疗法”实现了“1+1>2”的协同作用,增强了对癌细胞的“杀伤力”,目前已经获批肾细胞癌、结直肠癌、肝细胞癌和非小细胞肺癌等6大适应症。
不过,无论是“O+Y组合”,还是其他联合疗法,仍存在显著的毒副作用。基于此,能够降低毒性并提高疗效的双抗药物,开始登上历史舞台。
由于双抗能够特异性结合两种不同的抗原或抗原表位,具备联合疗法所不具备的生物学活性,成为了当下热门研发方向。
按照不同的作用机制,可将双抗分为9大类,包括T细胞桥接型双抗(如以CD3靶点为主的双抗,CD19xCD3、BCMAxCD3、CD20xCD3等)、免疫靶点相关的双抗等。
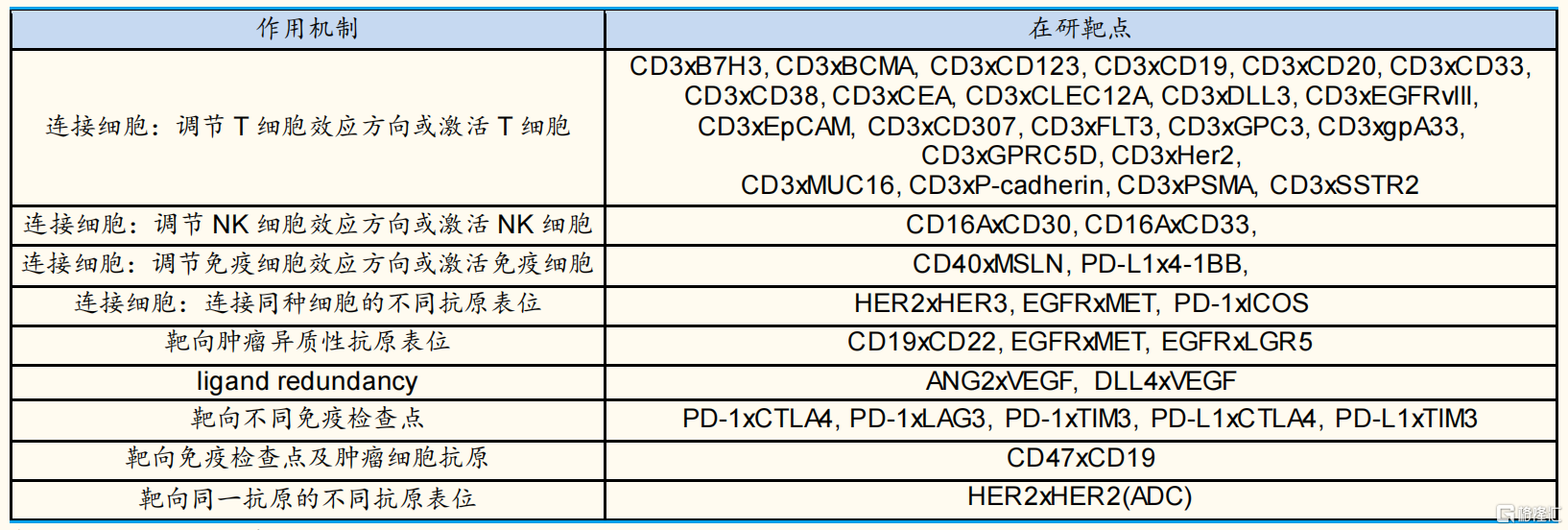
临床在研抗肿瘤领域双抗作用机制分类 来源:Pubmed,国金证券研究所
由于此前药企在肿瘤免疫治疗领域的布局主要以PD-1/PD-L1抑制剂为主,因此在双抗领域的布局多以PD-1(L1)为基础设计双抗,即以双免疫检查点阻断类双抗为主,组合类型包括PD-1(L1)xCTLA-4、PD-1(L1)xLAG-3、PD-1(L1)xTGF-β、PD-1(L1)xVEGF等。
这类基于PD-1设计的双抗药物,可以说属于第二代PD-1双抗体免疫治疗新药,一般也简称为第二代免疫治疗药“双抗”,包括康方生物的卡度尼利单抗(AK104,PD-1/CTLA4)、再鼎医药引进Macro Genics的特泊利单抗(PD-1/LAG3)、信达生物和礼来合作研发的IBI318(PD-1/PD-L1)等
以PD-1/CTLA-4双抗为例,通过提高双抗PD-1结合域亲和力,同时降低CTLA-4结合域亲和力,减少了CTLA-4对外周T细胞的结合,提升药物安全性。根据阶段性研究资料显示,卡度尼利单抗(AK104)比PD-1联合CTLA-4的联合疗法相比,毒性显着降低,具有明显的安全性和疗效优势。
此外,还有不少靶向PD-L1的双抗药物已进入临床阶段,包括康宁杰瑞的KN046(PD-L1/CTLA4)、恒瑞医药的SHR-1701(PD-L1/TGF-β抗体融合蛋白)、迈威生物的6MW3211(PD-L1/CD47)和普米斯生物的PM8002(PD-L1/VEGF)等。
二、康方生物领衔PD-1/CTLA-4双抗赛道,齐鲁制药、阿斯利康紧随其后
如前文所述,第二代免疫治疗药“双抗”已成为当下热门研发方向,而且目前已有产品实现商业化。
以PD-1/CTLA-4双抗为例。
康方生物的卡度尼利单抗(AK104)是全球首款获批上市的PD-1/CTLA-4双抗,也是全球首款商业化的基于PD-1的双免疫检查点双抗。
2022年6月,卡度尼利单抗获国家药监局批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者,成为首个获批上市的国产双抗。
从作用机制看,AK104可同时靶向PD-1和CTLA-4,与共表达PD-1及CTLA-4的肿瘤浸润淋巴细胞(TIL)四价结合,阻断肿瘤微环境中的两种免疫检查点分子,降低活化T细胞攻击外周位点健康组织的倾向。
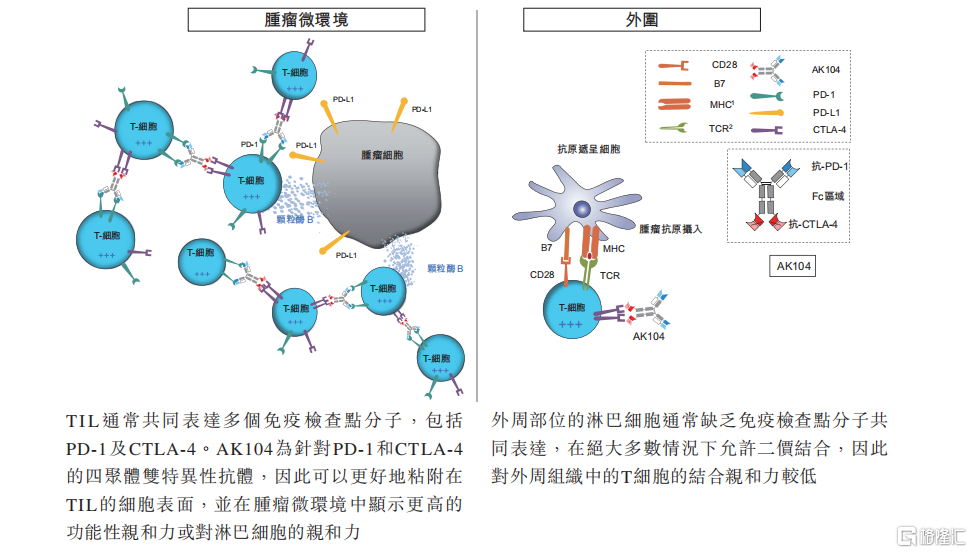
AK104作用机制 来源:康方生物招股书
从临床研究数据看,康方生物在2022 ASCO年会中公布了AK104联合含铂化疗+/-贝伐珠单抗,一线治疗复发/转移性宫颈癌(R /M CC)的II期临床研究结果(临床试验代码NCT04868708):在10mg/kg剂量组中,无论PD-L1表达,客观缓解率(ORR)为79.3%;针对CPS≥1的人群,ORR为82.4%;针对CPS<1的人群,ORR为75%;无进展生存时间(PFS)和OS数据尚未成熟。
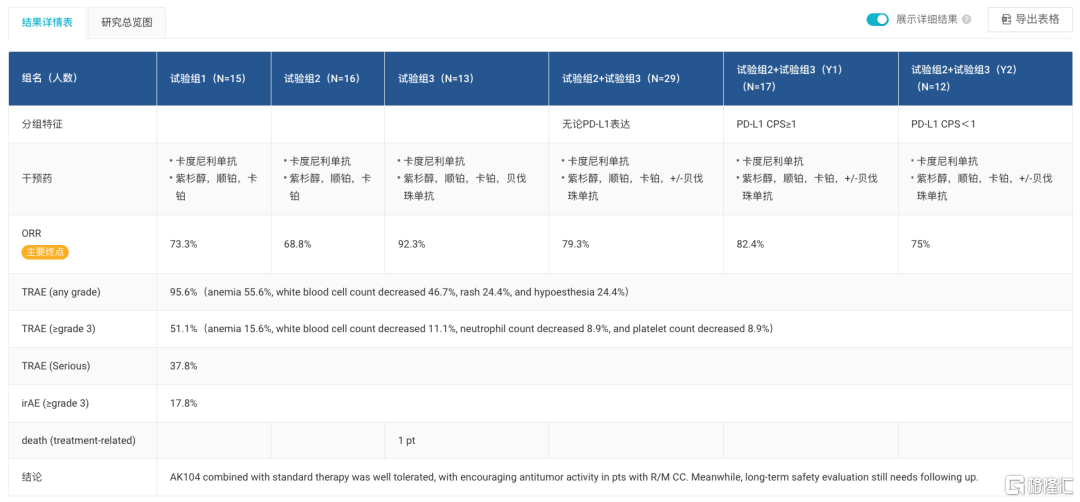
NCT04868708 试验结果 来自:Insight 数据库网页版
另外,卡度尼利单抗还在研发其他适应症,包括一线宫颈癌、一线胃腺癌/胃食管腺癌、局部晚期宫颈癌、肝细胞癌辅助治疗等均已处于临床Ⅲ期阶段。
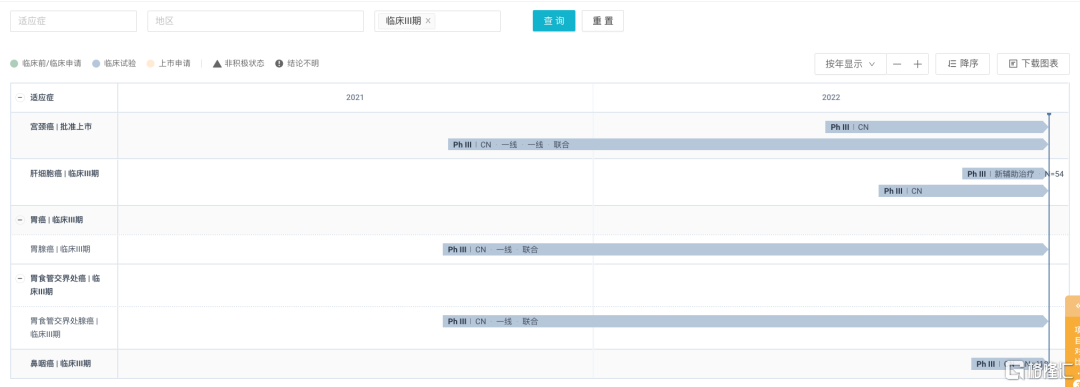
卡度尼利单抗 AK104 全球 III 期临床试验 来源:康方生物2022年中报
根据康方生物在2022 ASCO年会中公布的AK104联合卡培他滨、奥沙利铂(XELOX)一线治疗晚期胃癌或胃食管结合部腺癌(GC/GEJ)的Ib/II期临床研究数据(临床试验代码NCT03852251):有效性方面,在88名可评估受试者中,ORR达65.9%(58/88),DCR高达92%(81/88),中位缓解持续时间(DOR)为6.93个月(95% CI,4.60,11.20);安全性方面,卡度尼利联合XELOX的安全性良好,≥3级治疗相关不良事件(TRAE)为62.5%,未发现新的安全信号。
实际上,除了AK104以外,全球还有不少PD-1/CTLA-4双抗在研。
根据insight数据库显示,目前全球已有5款PD-1/CTLA-4双抗进入临床阶段,包括阿斯利康的MEDI-5752(沃苏米单抗)、Xencor的XmAb-20717(Vudalimab)、Macrogenics的MGD-019(Lorigerlimab);其中,国内百利药业的SI-B003已进入临床阶段。此外,齐鲁制药在研的 PD-1/CTLA4 单抗复方 QL1706 正在开展III期临床。
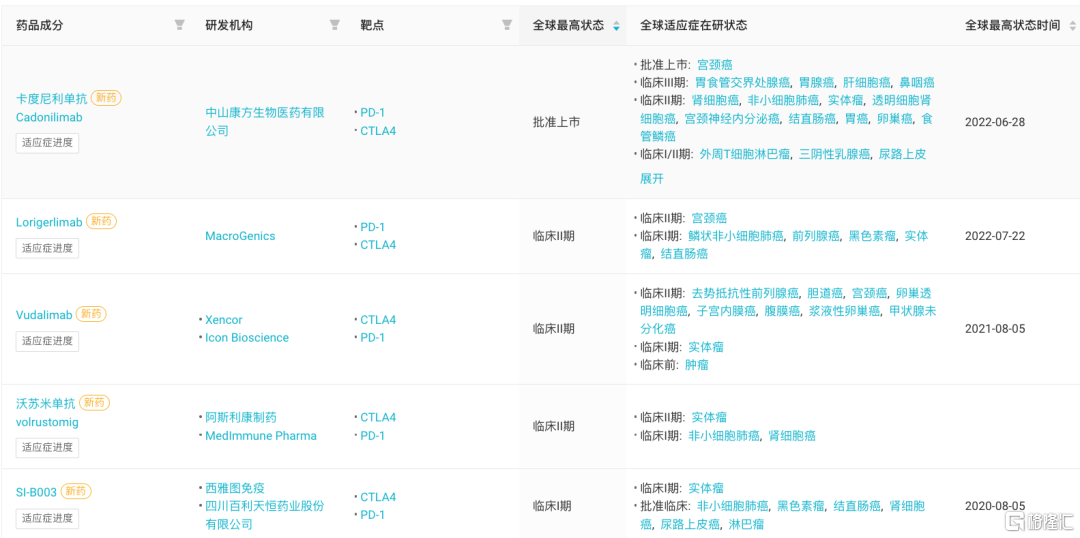
全球进入临床阶段的5款PD-1/CTLA-4双抗 来自:Insight数据库网页版
从临床研究数据看,阿斯利康在2022 ESMO会议中披露了MEDI5752一线治疗非鳞状NSCLC的1b/2期临床数据,患者在接受化疗后,在接受剂量为1500 mg(每3周一次)MEDI5752治疗的患者组中,患者的DOR为20.5个月,活性对照组(获批PD-1抗体/化疗组合)为9.9个月。MEDI5752组的PFS为15.1个月,活性对照组为8.9个月。而且,MEDI5752组在总生存期和肿瘤微环境方面,也表现出远胜于PD-1抑制剂的优势。
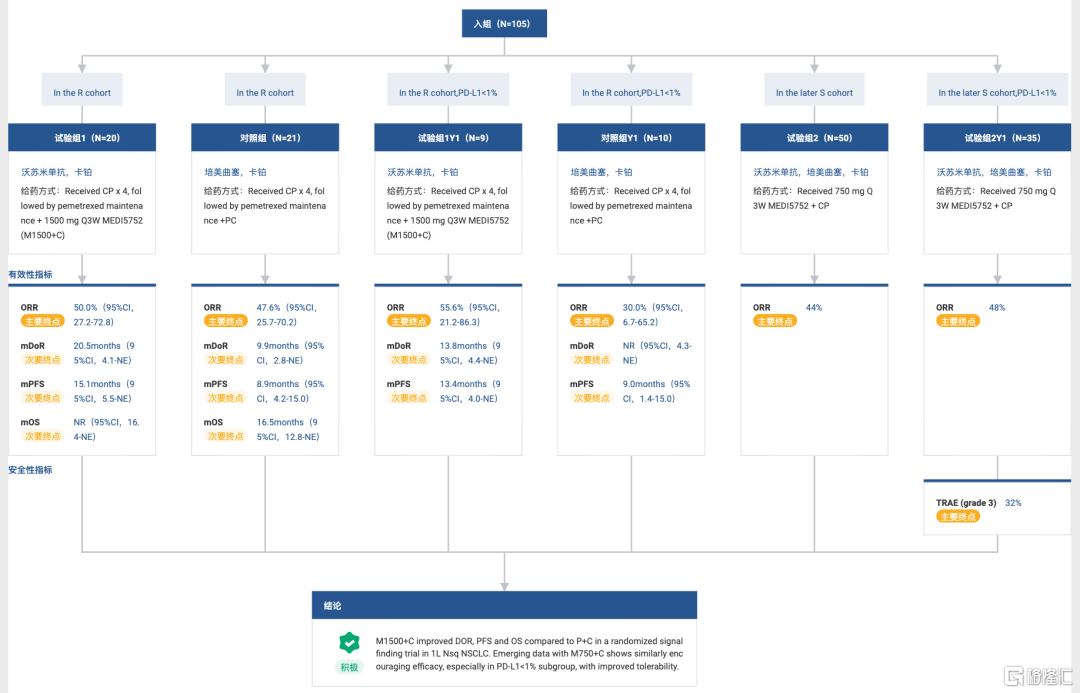
NCT03530397试验结果 来自:Insight 数据库网页版
前不久,齐鲁制药在2022 CSCO公布了QL1706联合紫杉醇-顺铂/卡铂加或不加贝伐珠单抗一线治疗未接受过系统治疗的复发或转移性宫颈癌患者的II期结果:显示出优秀的抗肿瘤活性。共有57例患者纳入疗效分析,ORR为77.2%,DCR为98.2%。
另外,齐鲁制药还在2022 ESMO上公布了QL1706联合化疗+/-贝伐治疗晚期非小细胞肺癌的II期临床研究结果(NCT05329025)。其中,针对EGFR野生型的晚期非小细胞肺癌患者:中位随访时间为9.17个月,ORR为58.6%(其中鳞状NSCLC:70.6%;非鳞状NSCLC:41.7%),DCR为93.1%(27/29),中位无进展生存期(mPFS)为6.97个月。
针对EGFR突变型的晚期非小细胞肺癌患者:中位随访时间为5.75个月,ORR为64.5%(20/31),DCR为93.5%(29/31)。PFS尚未达到,6个月的PFS率为61.3%。

NCT05329025试验结果 来自:Insight 数据库网页版
三、靶向PD-L1的双抗药物种类丰富,恒瑞、康宁杰瑞、友芝友……火热角逐
除了基于PD-1设计的双抗药物以外,靶向PD-L1的双抗药物研发也不在少数,而且双抗组合类型更加丰富。
据Insight数据库显示,目前总部所在地在中国内地的布局靶向PD-L1的双抗及多抗类型多有41种,其中主要集中在PD-L1xTGF-β、PD-L1x4-1BB、PD-L1xCD47、PD-L1xVEGF、PD-L1xTIGIT等领域。
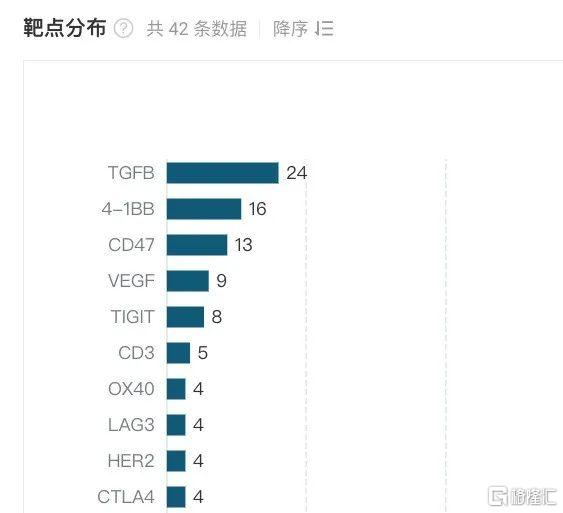
国内靶向PD-L1的双抗及多抗类型靶点分布(前10)
以PD-L1/TGF-β双靶点抗体药物为例,根据insight数据库,目前国内共有22款产品在研,其中进度最快的是恒瑞医药的SHR-1701,目前已开展针对晚期结直肠癌、非小细胞肺癌、胃癌等多种实体瘤的Ⅲ期临床研究;其次,普米斯生物的PM8001、友芝友生物的Y101D等均已进入临床阶段。
根据友芝友生物招股书显示,Y101D是一种重组抗PD-L1和抗TGF-β人源化BsAb,用于治疗晚期实体瘤。在战略上,Y101D专门用于同时抑制程序性细胞死亡蛋白1(PD-1)/PD-L1轴和TGF-β信号通路,因此具有释放协同抗肿瘤活性和缓解耐药性的潜力。目前正在I期临床试验中评估Y101D单药治疗转移性或局部晚期实体瘤的数据。
另外,根据弗若斯特沙利文的资料,暂无PD-1/PD-L1xTGF-βBsAb药物在全球获批上市,而国内有16款PD-1/PD-L1xTGF-β靶向管线处于临床试验阶段,其中,Y101D是唯一的 PD-L1xTGFBsAb,而其他15种管线为靶向PD-1/PD-L1xTGF-β的双功能抗体受体融合蛋白。
PD-L1/4-1BB双抗方面,根据insight数据库,目前全球共有20款产品在研,其中总部所在地在中国内地的有16款,包括天境生物/ABL Bio的TJ-L14B(ABL503)、德琪医药的ATG-101等。
根据德琪医药2022年中报披露,ATG-101用于治疗晚期/转移性实体瘤及B细胞非霍奇金氏淋巴瘤(B-NHL)的I期研究(PROBE-CN研究)已于2022年3月获国家药监局批准,并于2022年8月完成首位患者给药。
CTR20220652试验历史时光轴 来自:Insight数据库网页版
PD-L1/VEGF双抗方面,目前国内共有5款产品处于临床阶段,包括宜明昂科的IMM2510、华海药业的HB0025、普米斯生物的PM8002、天士力的B1962以及尚健生物的SG1408。
四、结语
在PD-1单药疗效不足、单抗联合疗法又存在显著副作用的背景下,基于PD-1/PD-L1设计的第二代免疫治疗药双靶点抗体类药物成为了热门研发方向。
除了已经抢得市场先发优势的康方生物以外,恒瑞医药、康宁杰瑞制药、友芝友、信达生物等知名药企也在火热角逐。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



