机构:东方财富证券
评级:增持
目标价:33.4港元
【评论】
多发性骨髓瘤患者的1B/2期临床试验获得FDA临床批准是公司与杨森合作的重要里程碑,是两家公司不到半年时间合作所取得的重大进展,也符合公司既定的战略发展规划。JNJ-68284528是以B细胞成熟抗原(BCMA)为靶点的自体CAR-T疗法,BCMA是一种在成熟B淋巴细胞及恶性血浆细胞表面表达的分子。JNJ-68284528药品表达的CAR蛋白与传奇的LCAR-B38MCAR-T产品表达的CAR蛋白完全一致。公司之子公司南京传奇生物科技有限公司目前正在评估用LCAR-B38MCAR-T产品治疗多发性骨髓瘤患者的安全性和有效性。评估结果显示,LCAR-B38MCAR-T产品对抑制多发性骨髓瘤具有令人鼓舞的效果,显示了良好的效果,公司也将通过后期临床试验对此加以确认。从2017年公布的70个病例数据来看,在可以分享的40个数据里,完全反应率达到60%
国家鼓励细胞治疗创新规范发展。2017年12月22日,为规范和指导参照药品研发及注册的细胞治疗产品的研究与评价工作,国家食品药品监督管理总局组织制定了《细胞治疗产品研究与评价技术指导原则(试行)》。CFDA明确在已有人体数据评估安全有效的前提下,可以免除不必要的动物试验。非注册临床数据真实、完整、准确且可溯源的,通过核查有可能被CFDA评估接受。与传统的I/II/III期临床分期不同,CAR-T的临床试验分期则分为“早期临床试验阶段”及“确证性临床试验阶段”。早期临床试验阶段的研究内容原则上应包括初步的安全性评价、药代动力学研究、初步的药效学研究和剂量探索研究。同时指出“必要时鼓励与药品审评机构沟通交流,以确保确证性临床试验方案设计的合理性”。临床数据收集弹性范围大。
CAR-T临床申请通畅反映公司强大的研究实力。根据CDE数据,2017年12月11日,传奇生物提交CAR-T临床申请成为国内首个获得受理的CAR-T项目。12月18日,LCAR-B38MCAR-T细胞自体回输制剂获准优先审评审批。2018年1月5日其技术审评完成,3月12日获CFDA的临床批准,成为国内首个获批的CAR-T临床项目。2018年5月30日,与Janssen合作的多发性骨髓瘤患者的1B/2期临床试验申请获得美国FDA批准。
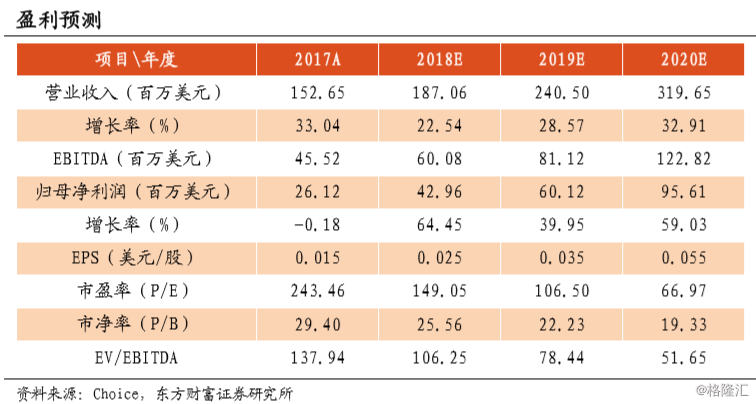
我们看好以CAR-T为代表的生物科技的创新发展前景,将造福更广泛的重疾患者。预期FY18/FY19/FY20归母净利润为42.96/60.12/95.61百万美元,每股收益0.025/0.035/0.055美元,对应149/107/67倍PE。6个月目标价33.4港元,维持给予“增持”评级。
【风险提示】
临床试验过程中不良事件的发生;临床试验数据结果不达预期;同类项目的过度竞争;
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员


