作者: 医药魔方
FDA肿瘤药物专家咨询委员会(ODAC)在7月12日讨论诺华CAR-T产品 Kymriah的上市申请时,花了整整一个上午的时间来讨论CAR-T细胞的GMP生产流程和质控。药品监管部门对细胞治疗生产过程和质量控制的重视程度可见一斑。
在刚刚结束的波士顿CAR-TCR峰会上,科济生物首席科学家&执行副总裁Cindy Ru博士应会议组织者邀请在生产分会场(Manufacturing Stream)做为首个发言人进行了一场题为“Fill the Gap to Share the Success(取长补短,分享成功)”的主题报告。医药魔方为此特别邀请茹博士就CAR-T行业最为关心的产品GMP生产和质控问题给大家做一分享。

Q:茹博士,您好!我们注意到您在这次波士顿CAR-TCR峰会上就 CAR-T细胞GMP生产做了一个主题报告。能否和国内同行分享一下您所报告的主要内容?
茹博:谢谢你们的专访!首先澄清一下,我过去十几年主要是在欧美大药企从事临床研究、药政申报和产品线的管理工作,虽然后来在辉瑞做血液肿瘤全球产品线负责人也负责管理生产部门,但当时的管理更多的是战略层面的,侧重听取BLA申报CMC部分撰写进展和上市后全球生产及运输等方面的定期汇报,并没有涉及太多的生产技术细节,所以我并不是CMC专家。这次会议主办方邀请我做主题报告,而且是整个生产分会场的第一个报告,我其实一直在试图说服他们把我的报告安排在转化医学分会场,分享一下科济生物的国内临床研究经验,但他们一再坚持,我也只好客随主便了。今天的分享也权当抛砖引玉吧,仅代表我的个人观点,欢迎大家批评指正。
Q:目前CAR-T还没有一套完整的质量管理规范,非常需要业内专家从各个层面充分讨论以达成共识,所以也请茹博畅所欲言,给大家多分享一些干货。
茹博:好的,我把过去9个月里自己对CAR-T细胞GMP生产方面的观察和思考先给大家简单分享一下。
科济生物从今年初就开始准备把CAR-T细胞生产技术转移到美国的第三方生产外包企业以支持美国IND的申报。我最初的工作重点是确定美国临床研究中心,把中国临床试验数据转移到美国,组织美国临床专家讨论美国一期临床试验设计并撰写试验方案。这方面工作开展的还比较顺利,但很快就发现生产转化落地是IND申报准备的瓶颈。所以从今年3月初开始,我拜访了许多美国CAR-T细胞生产中心,由此了解到了一些行业现状和中美之间的差异,最明显的一点就是产业结构的不同,当然技术创新水平的差异也有,但对产业发展趋势的影响相对弱一些。
在美国,从事CAR-T细胞生产的企业大致有三类:
学术界的生产外包服务中心,如医院、肿瘤研究所、或者大学再生治疗科研中心自己建立的GMP生产中心,像UPenn,MSKCC,MDACC,DFCI,CoH,UC Davis 等等。
工业界的生产外包服务公司,比如Lonza,PCT,WuXi AppTech 等等。
药物研发企业,比如Novartis,Juno,Kite,Bluebird Bio 等等。
从药政监管角度来看,这三类生产单位都必须先和无菌车间的建筑设计、施工公司以及仪器设备供应商协商好,按医政相关要求制定设计、施工、验收方案,然后向FDA申请召开Type C会议,在FDA审查并认可方案后,才可以开始施工。施工完成后,根据今后生产的不同用途,是支持临床早期实验生产,还是支持晚期及商业化生产,FDA会有不同的验收要求。
从行业服务范围来看,美国CAR-T企业分化度高,技术特色强,更多地呈现出技术互补而不是技术重复的状态。比如有专门做质粒的公司,有专门做病毒载体的公司,有专门做CAR-T细胞的公司。再比如,学术界的外包生产中心主要承接IND申报和单中心或少中心的I期临床试验生产,工业界的外包生产中心主要承接多中心的II期或III期临床试验的生产。对于研发企业,像诺华这样的跨国药企,选择的是临床早期用外包,II期之后的临床和商业化生产由自己承担;像Bluebird Bio这样的创新企业,更倾向于先用自己内部的生产中心完成流程优化,然后把技术转化给专业的生产外包公司进行大规模生产。
最近发生的Gilead对Kite的收购不仅仅是资本运作上的成功,也是产品生命周期管理的必然走向。如果详细了解诺华的生产流程、质量控制和自动化过程之后,你会发现诺华的CAR-T产品在全球率先上市其实是一个必然的结果,因为在满足商业化生产要求这方面,也只有像诺华这种资源丰富的跨国大药企才有实力投入足够的人力和物力去完成这种持续多年的巨大工程。
相比之下,国内现在能够进行CAR-T生产或者有潜力进入CAR-T生产领域的公司主要有三类:
第一类是专注原创CAR-T研发的生物制药公司,又可以细分为:1)有海外CAR-T公司生产技术和管理输入的,比如药明巨诺、复星凯特;2)在海外完成了比较成熟的CAR-T生产技术研发向国内进行技术转化的,比如Eureka 和 ProMab;3)有国内或海外CAR-T研发背景,主要在国内开展CAR-T生产和临床研发的,比如科济生物、斯丹赛、优卡迪、恒润达生、中源协和、吉觊基因、南京传奇、南京凯地、北京马力喏生物、北京艺妙神州等等。从地域上看,除了特别指明的几家公司之外,其它公司全部在上海及周边地区。而且近期还有新成立的CAR-T公司在不断地涌现,可能我们聊天这档口就有一家新的公司在注册呢。
第二类是从事干细胞研究的公司转型做CAR-T的,比如博雅控股、西比曼等,这类公司的技术优势是有已经通过国际标准认正的细胞库和相关管理经验,具有丰富的国际资本运作经验,无论是资金还是资源都比CAR-T start up雄厚的多。如果能够从国际渠道控制到垄断性行业核心技术,这类公司国际化的速度很可能会超过一些早期成立的国内CAR-T公司。
第三类是从事抗体生产的公司转型做CAR-T的,这些公司更多地是可能会演变成CAR-T产业链上的服务商,提供靶向高通扫描试剂盒、或者potency test研发服务等等。
如果和前面介绍的美国产业环境稍做对比的话,会发现中美的主要区别在于:1)国内现有的CAR-T公司技术特色不明显;2)产业分工合作意识薄弱,几乎所有CAR-T原创公司都是从质粒到载体到CAR-T细胞全部由自己生产;3)技术壁垒普遍不高,尽管各家公司的保密意识都很强,但像国外那种Cellectics、ZioPharm、CRISPR 或者Adaptimmune 多家公司拥有自己突破性特色技术平台的格局还没形成;4)对细胞治疗GMP生产中心设计、施工、和验收的经验有限;5)相关药政监管制度也还在酝酿中。
如果从产业整体布局对比来看,中国明显缺失品牌外包生产服务和医疗机构内部GMP生产中心这两块。相关的药政监管政策及制度也还不明确。不得不指出,导致CAR-T外包生产服务在国内发展缓慢的一个重要原因是由于对知识产权泄密的担心。所以未来几年国内CAR-T外包生产企业到底能否发展起来,或者说能否形成一定的产业规模,还是一个未知数。
Q:您刚才提到了诺华在生产流程、质量控制和生产自动化等方面都进行了大量的投入,您能否在这方面具体讲讲国内和国外在这些方面有什么样的异同呢?
茹博:好的。先说一下生产流程工艺优化吧。在CAR-T研发的不同阶段,生产流程工艺优化会有不同的侧重点。以临床前为例,对生产过程工艺优化的重点是保证CAR-T细胞制备的可行性。CAR-T细胞的生产制备是一次性的,如果生产失败,病人就彻底失去了治疗机会,不像传统药物,这个批次不合格了就用下一个批次,所以在进入临床研究之前,工艺优化的重点是确保CAR-T细胞生产的可行性。在这一点,国内外的研发目标是一致的,不同点主要体现在药政生产文件准备和生产过程文件管理习惯两个方面。
这些不同点也是有历史原因的,因为在国内CFDA一直到今年年初才将CAR-T治疗正式确定为药物研究,进行临床试验需要先向CFDA递交IND。目前所有已经结束的或正在进行中的CAR-T临床试验都是先向临床试验中心的伦理委员会递交实验计划书、研究者手册和患者知情同意书模版进行伦理审查,通过伦理之后开始患者招募的。伦理委员会对生产方面的文件没有具体硬性的要求。出于技术保密的原因,生产厂家一般也不提供与生产细节有关的文件。国外因为IND申报中提供CMC内容是硬性规定,所以申报者必须提供对生产过程、使用材料、使用仪器、生产方法和参数、质控方法和参数、产品描述、产品质控结果报告等文件。而且工业界提交IND的CMC部分往往比学术界提交的IND更详细、全面。
因为国内以前没有CMC要求,所以CAR-T企业对生产过程中的文件管理习惯更类似于学术研究。重要的生产方法研究、实验结果,生产记录、产品批号及某些产品放行质检报告可以溯源,但是对生产流程缺乏深入系统的理解,对所有可能影响产品质量的生产过程中的变量缺乏深入全面的分析,生产方法优化实验缺乏严格的统计设计和统计分析支持,因此优化结果往往只具有学术研究价值,但是不能满足国际标准的GMP, GLP要求。当然,你也可以把这些临床试验看作国外的研究者启动的临床实验(IIR),但美国IIR 试验也是要进行IND申报并递交CMC材料的。
接下来说质量控制这一块。我们可以拿I期临床试验举例说明中美之间的差异。
CAR-T细胞的生产过程中的质量控制主要包括三大块:1)对于生产过程的确认(Process Validation) ;2)生产过程中的质量监控(In Process Testing);3)产品放行的质量检测(Lot Release Testing)
具体到质控检测项目,以CAR-T细胞最后产品放行质检为例,主要包括:
1. Safety
- RCR/RCL test
- Sterility, endotoxin, mycoplasma testing
- vector copy numbers per transduced cell
2. Identity
- Presence of CAR sequence, etc
3、Purity
- Process and product related impurities
4. Dose
- Number of viable T cells express CAR
5. Potency
- Cytokines production, tumor cell killing, etc
这些产品质量控制指标其实也是生产工艺优化过程用来进行工艺评估的标准。
I期临床试验过程中利用临床药理、安全、疗效数据,放行产品质检结果和对病人血样的质检分析,企业会大量地进行生产工艺优化研究,以深入地理解生产中每一个步骤对最终产品的属性、临床安全及疗效的可能影响。这个时候选择什么样的分析方法进行质量控制中美之间还是有一些工作习惯和思考角度上的差异的。
在国内,质量控制方法的开发和确认更多是侧重于查阅科研学术参考文献,关注分析方法参数和实验条件的调整,关注分析方法的稳定性和重复性。当然这些都是对任何质量控制分析方法的最基本的、必须的要求。在国外大型药企里,设计和选择质量控制分析方法时更多地是从深入理解生产过程、产品生命周期、研发和生产成本控制的角度去考量。
打个比方,两个处于临床前阶段的做BCMA CAR-T的公司去找投资人。一个公司说,我的比他的好!那具体好在哪儿呢,转染率高?CAR阳性率高?用什么方法测出来的?你的分析方法确认过吗?你现在用的试剂盒3年以后还是不是最好的?你现在用的仪器5年以后还是不是在市场上继续销售?7年之后还有没有售后?这个方法不能确认的话,有其它可以确认的方法吗?III期临床和上市后产品的质检放行方法都要求必须是确认的分析方法,如果变更质检方法,SOP有做具体变更流程说明,并对诱发变更条件及变更评估的详细说明吗?等等,一个简单的问题到后面其实会牵扯出一系列的重大问题。
那你也可以说,我还没上临床呢!我准备在I期临床的时候做确认性质检方法研究。可以呀,但是把风险评估方案、完整的SOP、可能涉及的研发成本和生产成本先拿来看看吧……
你可能会认为一个分析方法能值几个钱?CAR-T领域里分析费用还真不是小钱!做一套标准的CAR-T放行检测,欧美行业内各公司报价非常接近,6~7万美元之间不等,而且这只是一个病人的一批T细胞产品的分析费用哦!
所以说,如果自己在优化工艺的同时也建立可确认的质检分析方法,并能有效地控制该方法的研发和使用费用,从而直接地降低CAR-T产品的研发和生产成本,那在提供类似的安全和疗效结果情况下,这样的产品就会有更好的市场竞争力!
这里举这个例子主要是想说明,从科研转型做工业研发的团队一定要不断强化以终为始的工业化研发意识,只有这样才能保证少走弯路、降低研发成本和风险,提高企业自身的市场竞争力。
最后简单说一下自动化方面的不同吧。
国内现在所有的CAR-T Start Up公司都在临床前、甚至I期临床阶段,所以应该把研发精力和资源集中放在深入了解工艺流程、完善流程中的人、物流及文件的SOP管理、提高放行产品的临床安全和疗效属性、降低产品在Modular生产模式下的生产成本,认真学习国外早期临床研究设计思路及方法和GCP管理经验,认真学习国外临床研究中统计设计和分析的指导性地位,争取把产品在I期结束时做到尽善尽美,卖给国内外大药企去做后期研发和上市工作。这是对社会资源的尊重和最好利用。CAR-T start up 公司千万别跟风去炒自动化这个概念、误导投资者,还是先好好把基础研发做好。
在细胞治疗领域里,工业自动化的主要目的是最大化地降低生产过程中的变量和生产成本。前者直接影响产品在临床上的安全性和疗效,后者直接影响细胞治疗的价格。降低生产成本才可以让更多癌症患者能负担得起这种昂贵的治疗。所以细胞治疗领域工业自动化是整个产业发展必然走向。尽管大家都知道这个趋势,但是现在既使在欧美,真正玩得有模有样的也只是诺华这一家!诺华是怎么玩的,一手拉着GE,一手拉着BD, 利用已经收集到的600多个病人的数据,梳理所有生产步骤中的变量,联合GE、BD一起从头设计CAR-T细胞自动化生产线。这里可以分享几张诺华和GE自己公开的幻灯片。
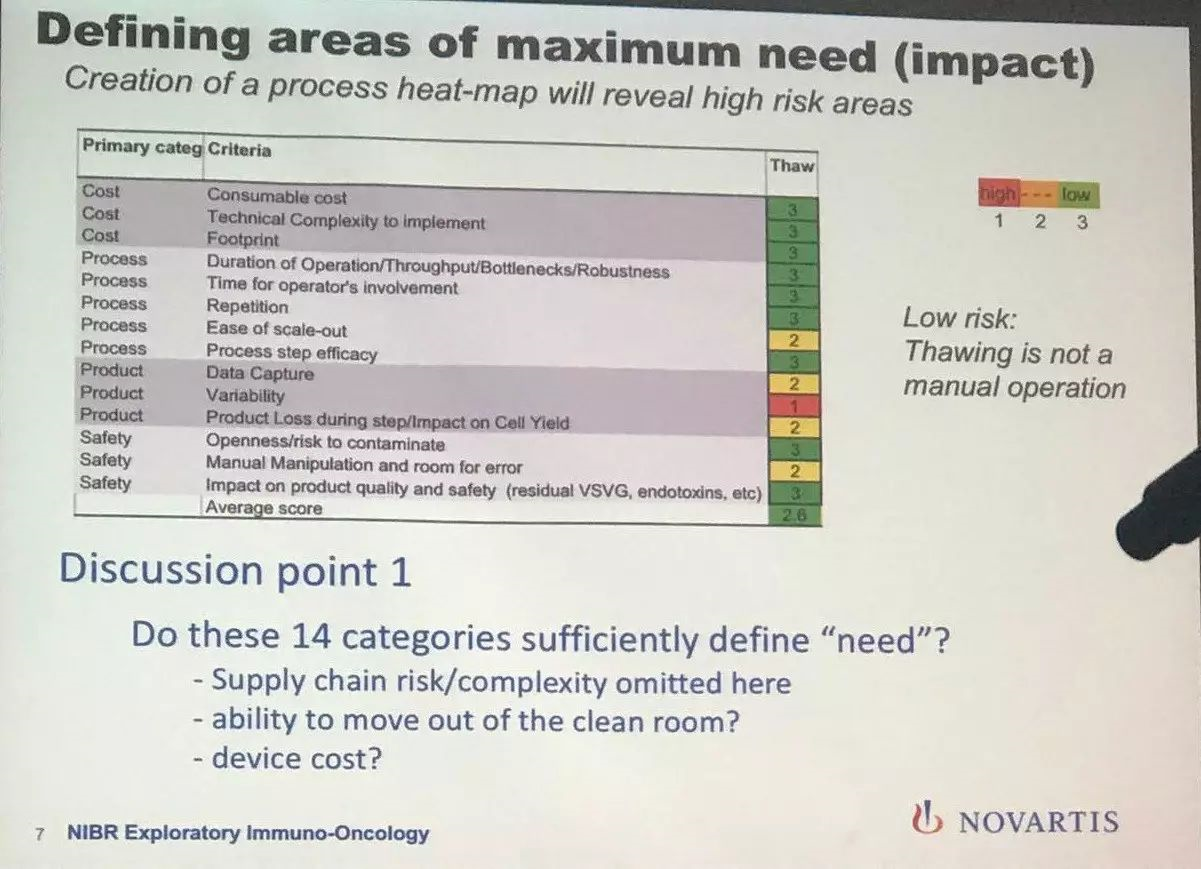
这张是举例说明如何分析生产步骤中涉及的变量的。
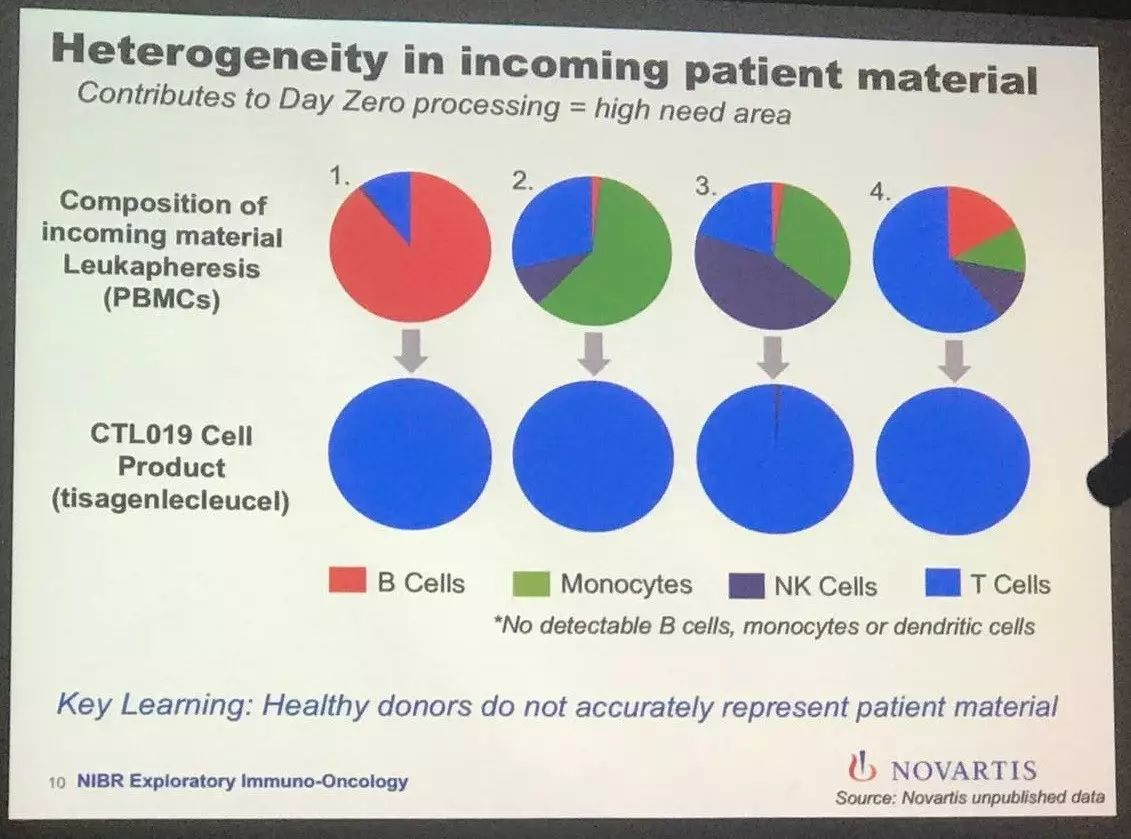
这张是举例说明控制系统下不同病人的血液样品处理后结果完全一致。
下面这张是介绍研发自动化仪器所需要的时间和费用。
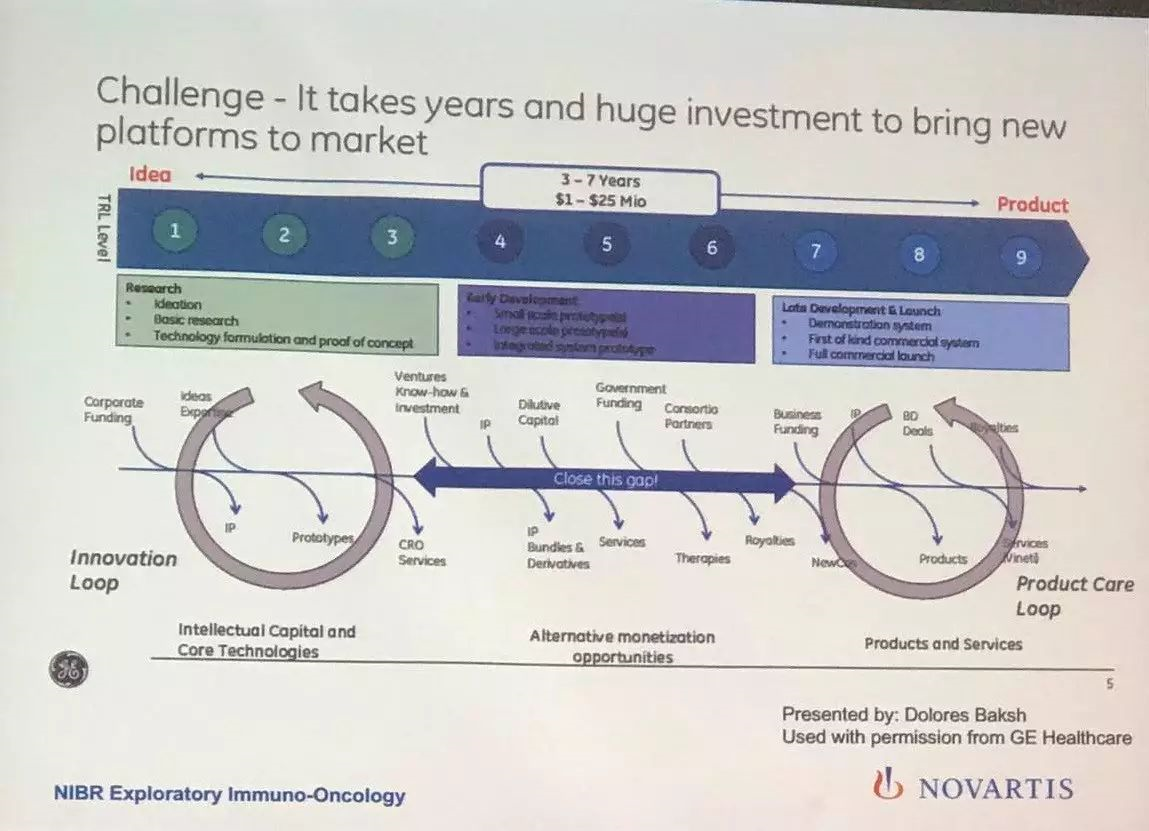
这种研发及社会资源的调动不是一般公司负担得起的。而且对于许多中、小型研发为主的公司也是完全没有必要的投入。让他们先玩儿着,等到自动化系统成熟之后当个用户也挺好。
这次会议上Lonza也介绍了他们推出的自动化系统,就是这张照片——Cocoon(大茧蛹),这个名字起的太Cute了。不过真得是又上口又好记又形象,寓意还好!你的产品放进去生产就会化茧成蝶、破壳而出啊,Lonza市场部的人真的是很用心,连这个外型颜色都是工艺需求和艺术设计的完美结合。Anyway,他们自己公布的数据是把57小时的流程压缩到16小时,什么概念,以前7个工作日的流程,现在自动化仪器不到1天就做完了。这个如果真像他们介绍的那么好的,临床意义还是蛮大的。

这次峰会上其它一些中小公司都介绍了自己在自动化过程中软硬件的各种进展。这个领域需要的是全封闭、全自动、技术壁垒高的垄断性产品。这样的产品总有一天会出现的,但现在是大浪淘沙,还得热闹一阵子。
Q:非常感谢茹博的精采分享。最后一个问题,您认为目前全球CAR-T产业共同面临的最大挑战是什么?
茹博:非常好的问题。这次峰会上Plieth客观冷静地分析了全球CAR-T产业目前面临的6个挑战。就是下面这张照片,他把理性的分析都说了,我就来说点感性的吧!

最大的挑战就是人!人才荒啊!巨大的人才荒!
我个人始终坚信这世界上最大的财富就是人!你看今天世界上的哪一项技术、哪一个奇迹不是人类做出来的!只要有人才,所有的困难都会最终解决的。这个人才荒到什么程度呢?FDA介绍说自己的CDER只有大约60个评审专家,CBER只有10多个人!要知道制CAR-T领域几乎一天一个样啊,而且都要经过临床确认安全性、疗效,都要建立并完善生产质控的药政监管原则和标准。虽然听起来都是细胞治疗,其实每个新技术后面都有大量独特的Bio Processing。
全球工业界往前冲的同时也给各国政府的医药监管部门带来了巨大的工作压力。去年年底EMA的Workshop和今年FDA的ODAC都向这个新兴产业展示了欧美药政监管部门的开放合作态度,因为肿瘤细胞治疗的确是一个需要政府药政监管部门和研发企业以及临床医生密切沟通、共同探索的新兴产业。
说到工业界的人才储备,缺囗用“巨大”两个字已经不足以形容了。为什么呢?因为常规情况下工业界的人才流动模式在细胞治疗领域里基本行不通了。打个比方,别的领域要招人,用人单位给猎头打电话,你给我找个有相关经验的人来!什么叫相关经验,做小分子的继续做小分子,做抗体的继续做抗体,实在急了,做小分子的招来培训一段时间做抗体也行,做普药的招来培训一段时间做肿瘤也行。但是到细胞治疗就走不通了,无论是小分子靶向药物还是抗体药物,从生产到前临、临床、药政、上市后管理过去经验基本都不适用了,全得重头学,而且是mindset changes。企业这时候会考虑一下用人成本,既然都得重头学,还不如直接招聘高校新毕业的本科生、研究生。问题又来了,这些人养成良好的工业界工作习惯,至少得二、三年。如果没有完善健全的培训系列,最后就是四不像,直接影响研发质量和成本。
在这方面,国内外情况完全一样。这次CAR-TCR峰会上听说诺华细胞治疗这块明年准备新设100~200个岗位。问题是去哪儿招这些人呢?最明显的答案就是去其他CAR-T公司挖有相关经验的人。但是如果从行业整体上,人才荒的问题不仅没解决反而更加严重了。
昨天BD公司的人甚至直接问Bruce宾夕法尼亚大学是不是应该考虑开设一些与细胞治疗生产研发相关的本科专业,好让自己孩子去念,以后好找工作,Bruce也只能是苦笑一下,没法儿正面回答她的问题。
国内人才荒的问题就更严重了!国内现在严重缺乏具有国际工业界新药专业研发经验和新药上市申报管理经验的人才。现在国内层出不穷的CAR-T start up,创始人背景主要来自三个领域: 国内高校教授,美国高校 CAR-T研发人员(尤其是有宾大背景的),美国工业界在CAR-T前临床研究领域的研发人员。这些创始人的优势是拥有细胞免疫领域的深厚扎实的科学理论功底,对新技术敏度,并在技术方面拥有较强的转化能力,年轻有魄力,有国际化意愿,但是凭借几个CAR-T专利,能生产CAR-T,甚至拥有一些临床数据,距离像诺华那样把一个CAR-T产品推向市场还有很多需要解决的问题。
在欧美做过临床研究、新药上市管理的人,多年工作下来都会养成对各种发现性研究、临床前疗效数据、临床I/II期实验结果抱以谨慎乐观态度的习惯。最终能上市并且给研发公司带来巨大利润的产品真是凤毛麟角,而且能走到那一步拼的是大药企雄厚的资源、全球研发团队的人才配备以及产品线负责人的眼界、经验及判断力!所以,中国的CAR-T公司不论是想在国内上市还是想走向世界,引进有海外工业界相关经验的专业人士和新药上市经验的高级管理人才并虚心学习取长补短是企业高速发展的保证。但是这执行起来真的有难度。第一,欧美也面临类似的人才荒,第二,国内外药企在工作环境、企业文化和福利待遇等方面巨大的差异往往使许多海外专业人士近乡情却。慢慢来吧,面包会有的~
谢谢茹博!再次感谢您百忙之中接受我们的采访,给大家深入剖析了这么多现实问题。也非常期待您在11月份上海峰会上的精彩讨论。
(文章来源:医药魔方)
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



