
近日,Regenxbio公司报告了其AAV基因疗法RGX-202用于4~11岁杜氏肌营养不良症(DMD)的I/II期试验的安全性和有效性。
Regenxbio预计2024年中期决定关键试验中的推荐剂量,并于2024年下半年启动一项关键试验。
杜氏肌营养不良症
杜氏肌营养不良症是一种罕见且严重的遗传性肌肉疾病,由抗肌萎缩蛋白基因突变导致。
2023年6月22日,美国FDA加速批准Sarepta公司的DMD基因疗法Elevidys上市,用于4~5岁患有DMD且已确认DMD基因发生突变的门诊儿童患者。由此,Elevidys成为首个治疗DMD的一次性基因疗法。但Elevidys禁用于DMD基因外显子8和或外显子9有任何缺失的患者。
而Regenxbio公司的AAV基因疗法RGX-202可能对目前无法接受Elevidys治疗的患者提供新治疗选择。这款药物利用了尖端的NAV® AAV8载体技术,旨在修复导致DMD的关键基因缺陷,并通过独特的设计改善肌肉功能。
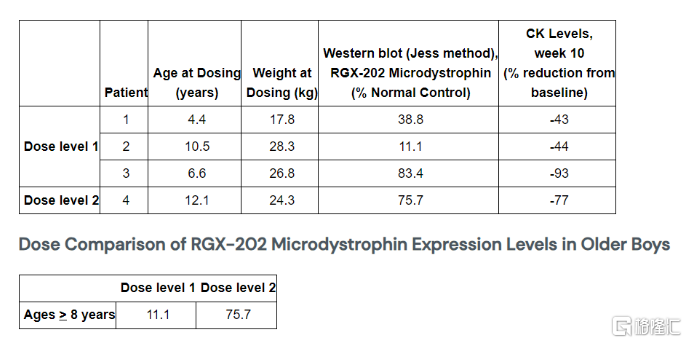
截至2024年2月28日,RGX-202(包含剂量水平1:1x1014GC/kg和剂量水平2:2x1014GC/kg)在5名DMD患者(年龄为4.4~12.1岁)中皆呈现良好的耐受性,没有发生与药物相关的严重不良事件。给药随访时间7周~11个月。
其中4名患者完成3个月试验评估,出现临床改善,因为RGX-202微肌营养不良蛋白的表达皆有所增加,血清肌酐激酶(CK)水平较基线有所下降。
而1名接受RGX-202剂量2治疗的12.1岁患者,与标准对照相比,三个月时其RGX-202微肌营养不良蛋白表达为75.7%,十周时其血清CK水平较基线降低了77%。
早在2023年1月,RGX-202的I/II期临床试验正式启动,并开始招募受试者参与研究。FDA已授予RGX-202快速通道资格、孤儿药称号以及罕见儿科疾病用药认定。
RGX-202药物基本信息

截图来源:药融云全球药物研发
此次DMD基因疗法RGX-202积极数据的公布,表明该疗法可对年长的DMD儿童有效,为不能接受Elevidys治疗的5岁以上患者提供治疗选择。
Regenxbio由基因治疗领域开创者James Wilson参与建立,拥有NAV技术平台,拥有超过100种AAV血清型的专利权,包括AAV7, AAV8,AAV9,AAVrh10等,并授权给多家基因治疗公司,其中诺华已获批的治疗SMA疗法Zolgensma使用了AAV9。
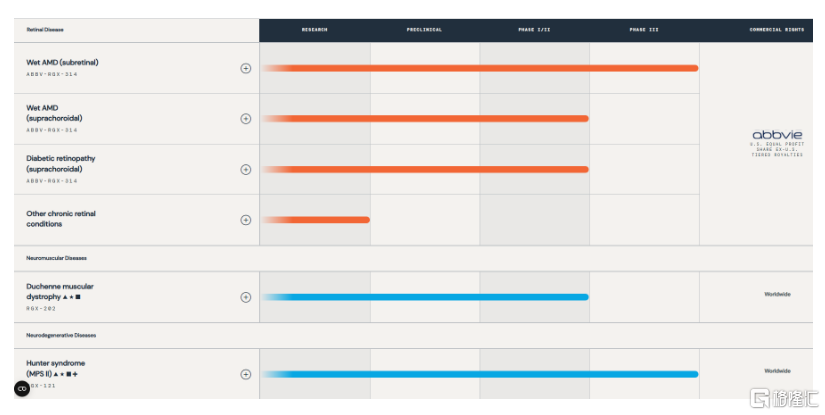
Regenxbio自研的产品管线涉及眼科疾病湿性年龄相关性黄斑变性、神经肌肉系统疾病杜氏肌营养不良症、神经发育疾病亨特综合征等。目前进度最快的产品是RGX-314、RGX-121,都已进入临床III期阶段。
研发管线
END
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



