11月24日,恩沃利单抗(KN035,商品名:恩维达®)正式获批上市,成为全球首个皮下注射PD-L1抑制剂。由康宁杰瑞作为原研方负责生产和质量,思路迪医药负责肿瘤领域的临床开发,先声药业负责产品在中国大陆的独家推广。
近期,恩维达®价格揭开面纱。按照200mg/1.0ml/瓶/盒规格每支的定价为5980元,每疗程使用4支,每疗程药费为23920元,一年12疗程(周期)。
为了满足患者对创新药物的可及性需求,患者援助项目方案也初步亮相。根据“4+4,8+PD”(即买4支申请援助4支,再买8支申请援助至疾病进展)救助方案,生存获益且符合患者救助项目首轮救助和后续救助条件的患者,治疗总费用不超过71760元。推测基于其差异化优势,恩维达®定价高于国产同类产品。
目前,我国已上市的进口PD-L1产品,如罗氏的泰圣奇®(阿替利珠单抗)赠药到进展以一年为限,一年治疗费用约13.1万元;阿斯利康的英飞凡®(度伐利尤单抗)针对治疗小细胞癌和非小细胞肺癌的每年治疗费用分别为16.2万元和14.4万元。相比之下,恩维达®的费用不到进口同类产品的一半。
从进度上来看,不到两周时间,恩维达®已经完成了从拿到获批证书到开出首批处方药的华丽转身。在风起云谲的“PD-(L)1”竞争中,“进阶之战”仿佛已经打响。那么对于这个全球首个皮下注射PD-L1应当如何去看?对于原研方康宁杰瑞而言,又意味着什么?
30s完成注射:全球首个皮下注射PD-L1,创多项“第一”
作为网红靶点PD-(L)1,随着多家产品相继上市,持续拓宽适应症领域,新型治疗方式正在逐渐走入寻常百姓家。对于创新药企而言,如何在PD-(L)1持续火热之时走出差异化破局之路,显得尤为关键。
而恩维达®作为康宁杰瑞自主研发的PD-L1抑制剂,现已实现了多项突破,拥有多项全球或者中国“首个”称号:
(1)全球首个皮下注射的PD-L1药物。目前全球已上市的PD-(L)1单抗均为静脉注射类型,静脉使用免疫存在较大临床风险,可能导致体温迅速下降,血液中电解质失衡,甚至出现形成血栓。皮下注射剂型安全有效,使用便捷,为静脉注射不耐受患者带来希望。由于恩维达®能够在室温下保持稳定,在生产、运输和储存等方面具备更大的产业化优势,未来更有望实现居家给药,治疗可及性大大提升。
(2)首创PD-(L)1单抗30s完成注射给药应用记录。在给药方法及时间上,静脉注射类型平均给药时间约 1-2 小时。而恩维达®作为全球首款皮下注射的 PD-L1 药物,细针管相比传统注射泵给药更加边便捷,仅需 30 秒就可完成给药,大幅减少了单个患者的给药时间,极大改善患者生活质量。
(3)中国首个国产PD-L1抑制剂。相较于市场上已获批的PD-1单抗,在恩维达®获批之前并无国产PD-L1单抗拿到批文。此番恩维达®上市也正式成为中国首个国产PD-L1抑制剂产品。
(4)中国首个且唯一一个取得跨瘤种适应症的免疫治疗药物。恩维达®获批的适应症为MSI-H/dMMR的成人晚期实体瘤患者的治疗, 包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者,以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者,也是中国首个获批治疗MSI-H/dMMR泛肿瘤适应症的免疫治疗药物。
作为拿到多个“首创”的恩维达®,其临床表现也十分优秀,无论是有效性还是安全性都得到验证。
从临床表现来看, 2021年CSCO大会上公布了恩维达®二线治疗MSI-H/dMMR的最新数据。在疗效方面,其ORR为44.7%,CR为11.7%,mPFS为11.1个月,更有73.6%的晚期患者生存时间超过一年。与同类治疗MSI-H/dMMR的药物相比,恩维达®疗效数据非常可观,与同类进口产品相当。
在安全性方面,研究中没有发生免疫相关性肺炎、免疫相关结肠炎、免疫相关肾炎等不良反应,三“零”不良事件展现出恩维达®更优的安全性。其中,恩沃利单抗在结直肠癌、胃癌、子宫内膜癌、前列腺癌、胆管癌等多个瘤种的 MSI-H 患者中 ORR 超过 40%,证实其疗效确切,与同类进口产品相当,而且绝大部分获益的患者仍在继续用药,获益时间长。
图表一:安全性结果
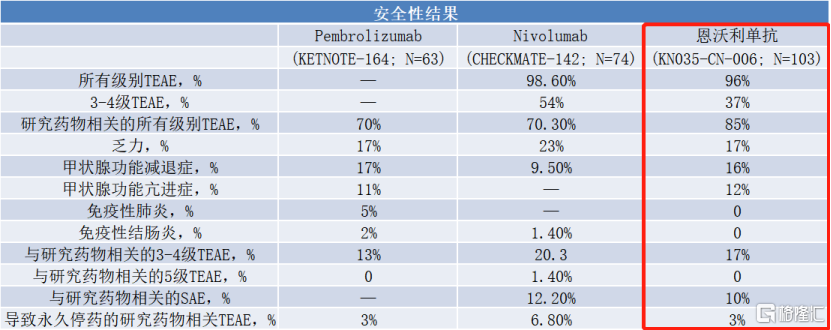
数据来源:2021CSCO,格隆汇整理
图表二:MSI-H/dMMR实体瘤治疗研究结果
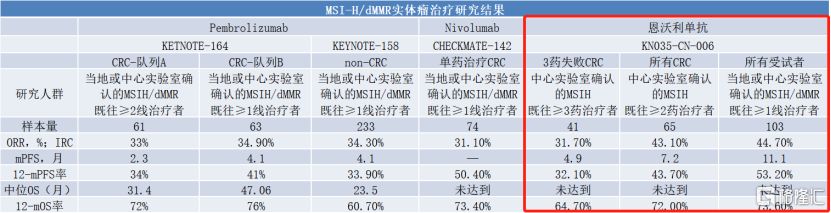
数据来源:2021CSCO,格隆汇整理
差异化创新优势显著,全方位挖掘治疗潜能
未来可能实现在家就能治疗肿瘤的恩维达®,在获批上市后,最受关注的首先就是它的价格。
从公开的信息可知,恩维达®每支的定价为5980元,每疗程使用4支,每疗程药费为23920元。并且考虑到患者的可负担性,推出了“4+4,8+PD”(即买四支申请援助4支,再买8支申请援助至疾病进展)救助方案,符合患者救助项目首轮救助和后续救助条件的患者,恩维达®治疗总费用低至71760元。
目前除了恩维达®,国内已经获批的还有两款进口PD-L1产品。
从销售端来看,作为首个国产PD-L1产品,与进口PD-L1相比有价格优势。目前,我国已上市的同类进口PD-L1产品,如罗氏的泰圣奇®(阿替利珠单抗)的赠药方案以一年为限,一年治疗费用约13.1万元;阿斯利康的英飞凡®(度伐利尤单抗)针对治疗小细胞癌和非小细胞肺癌的治疗费用分别为每年16.2万元和14.4万元。
从成本端来看,相较于进口PD-L1产品,单次剂量小,药企有成本优势。从抗体用量上来看,恩维达®采用150mg QW的剂量,临床研究支持后续推出300mg Q3W或者400mg Q4W的固定剂量给药方案,年化用量显著少于其他PD-L1单抗,潜在的成本优势较大。
图表三:我国进口PD-L1抗体用量对比
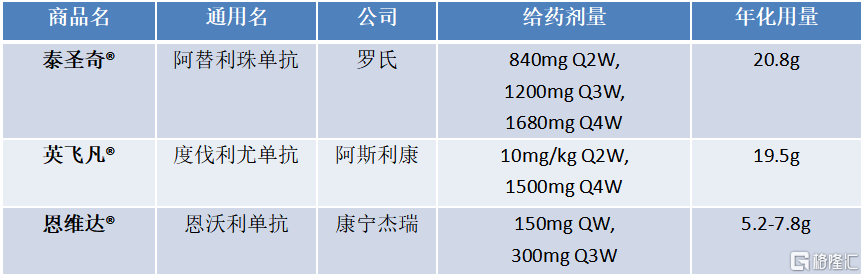
数据来源:公开资料,格隆汇整理
另外,除了已经获批上市的适应症外,恩沃利单抗还在中国、美国、日本同步开展针对多个肿瘤的多中心临床试验,并被美国FDA授予治疗晚期胆道癌、软组织肉瘤的两项孤儿药资格,其在美国进行的治疗软组织肉瘤的注册临床研究进展顺利,有望于2022年申报上市。
小结
在医改进入深水区之下,国内药企迎来创新发展的大风口。伴随着大量玩家不断涌入风口,越来越多药企逐渐从me-too 开始走向me-better乃至于best-in-class/first-in-class。但是相比于创造所谓的BIC/FIC,以临床需求为导向日益成为真正的关键所在。
作为国产首个PD-L1产品,不仅创造了全球首个皮下注射的新型给药方式,更是通过30s注射,单域抗体结构等优势,为患者带来了实质性的便利和获益。
恩维达®作为康宁杰瑞首个商业化产品,叠加其合作伙伴先声药业在肿瘤商业化网络上的布局及肿瘤产品的销售能力,标志着公司正式步入商业化元年,从早期的Biotech向Bio pharma企业迈进。血液中流淌着“创新”的康宁杰瑞,未来也将凭借这个优质特征在一众创新药企中脱颖而出,值得期待。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员


