十九世纪以来,全球的生物制药工业经历了小分子药物和蛋白类药物两大浪潮,但二者的研发受到靶点可成药性的限制。随着新靶点的研发难度日益增大,创新的小分子和蛋白类药物的开发难度也不断增加。
小核酸药物则是以核酸为靶标,通过对蛋白翻译过程的调控来实现疾病治疗,具有靶点丰富、研发周期短、药效持久、临床开发成功率高等优势。经过四十年余年的研究积累,小核酸药物在化学修饰、药物递送方面不断取得进展。近两年,小核酸药物呈现加速获批态势,特别是疫情期间,新冠mRNA疫苗在研发效率和药物疗效方面所展现的优越性让人们看到了核酸药物的巨大潜力。
未来,具备平台属性的小核酸药物的治疗领域将不断拓展,有望引领第三次现代制药的浪潮。通过修饰方法和递送系统的优化,进一步提升药物稳定性和生物利用度、降低毒副作用是小核酸药物开发的关键所在,拥有修饰和递送核心技术平台的企业值得重视。
导读:
靶点的“可成药性”在一定程度上限制了小分子和蛋白类药物的创新发展,而小核酸药物以核酸序列为靶标,极大地拓展的靶点范围,有望引领下一个创新制药浪潮。具备核酸化学修饰和药物递送等核心技术的企业将在行业发展中脱颖而出。
一、 小核酸药物:调控蛋白翻译,突破“不可成药”限制
1.1
核酸药物通过调控病蛋白翻译实现疾病治疗
人类很多疾病的发生都与蛋白质的结构、功能和数目变化密切相关,而人体内蛋白质的合成均遵循中心法则。中心法则是指遗传信息从DNA传递给RNA,再从RNA传递给蛋白质的转录和翻译过程,以及遗传信息从DNA传递给DNA的复制过程。根据中心法则,蛋白质的合成受到核酸的指导和控制。随着分子生物学的发展,研究者还发现,尽管有些 DNA/RNA 并不被转录/翻译为蛋白质,但对转录/翻译过程起着重要的调控作用,如DNA中的启动子、增强子, RNA中的核酶、微小RNA(miRNA) 、小干扰RNA(siRNA) 、小激活RNA(saRNA)等。因此,人们也开始在核酸层面进行药物设计,小核酸药物即是通过直接作用于与致病蛋白相关的RNA,调控蛋白的合成,进而达到治疗疾病的目的。狭义的小核酸是指siRNA,而广义的小核酸则涵盖了siRNA、反义寡核苷酸(ASO)、miRNA、saRNA、信使RNA(mRNA)、适配体(Aptamer)等一系列能参与转录后基因表达调控的小核酸。小核酸药物实现疾病治疗的思路主要有两条:一方面,可以针对细胞内的mRNA、非编码RNA(ncRNA)等,通过基因沉默抑制蛋白的表达从而实现疾病治疗;另一方面,对于由蛋白缺乏导致的疾病,也可引入saRNA上调目标基因的表达,或引入mRNA表达所需的蛋白,进行蛋白替代治疗。
图1 中心法则及各类药物主要针对的靶点
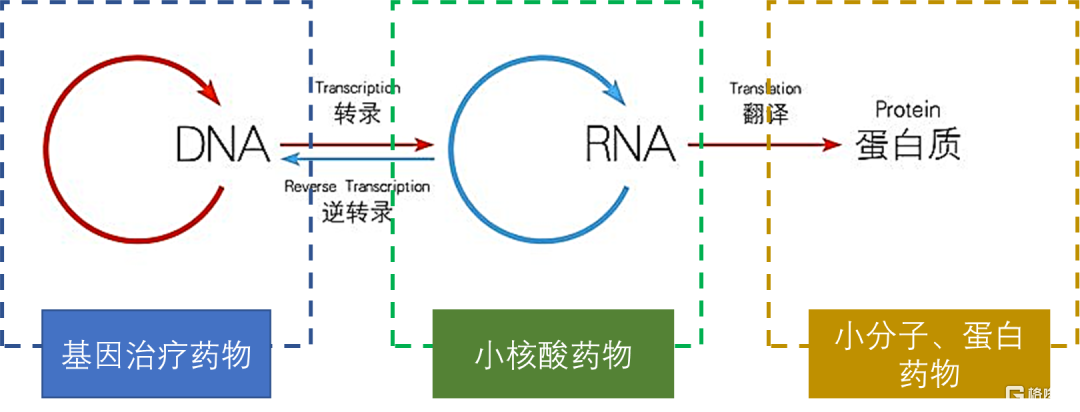
资料来源:国泰君安证券研究
表1 各类常见的RNA及其功能
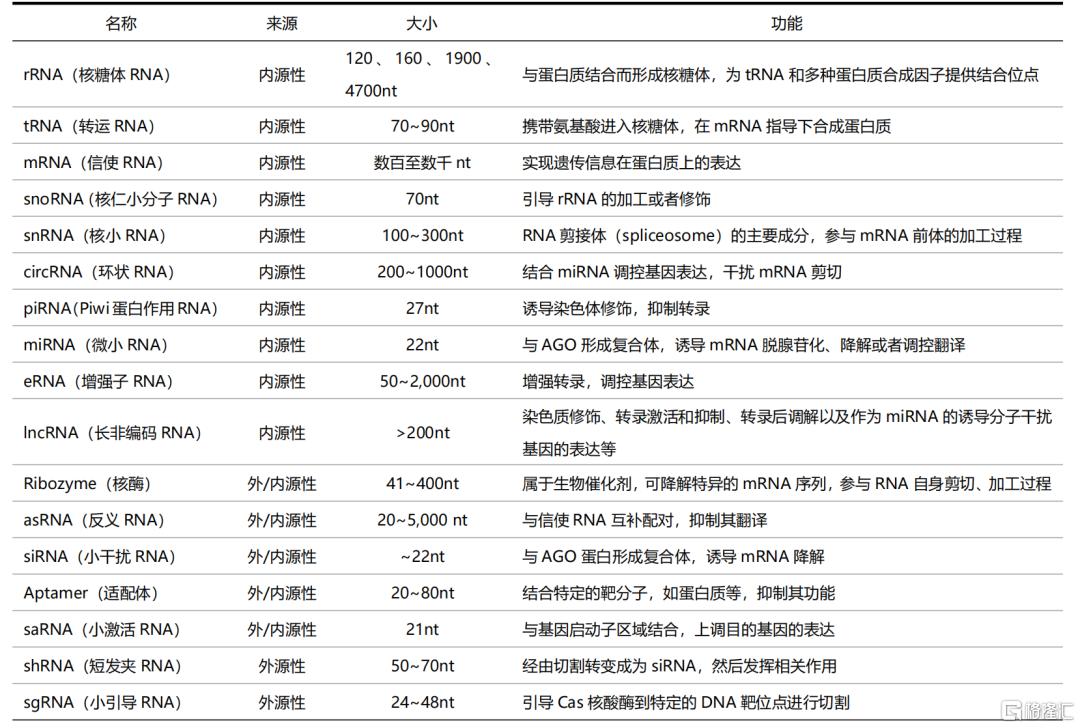
资料来源:《RNA种类、结构及功能的多样性》,国泰君安证券研究
1.2
扩大靶点范围,小核酸药物差异化优势显著
小核酸药物是与小分子药物、抗体药物完全不同的全新药物类型,其作用机理、研发模式、生产工艺、药代药效特征等性质均与小分子和抗体药存在较大差异,这些差异也赋予了小核酸药物显著的差异化竞争优势。与目前主流的小分子和抗体类药物相比,小核酸药物具有候选靶点丰富、研发周期短、药效持久、特异性强、临床开发成功率高等优势,其可针对难以成药的蛋白靶点开发靶向上游核酸层面的治疗药物,有望攻克尚无有效治疗药物的疾病。
(1)候选靶点丰富
小分子和抗体药物均是通过与靶点蛋白结合发挥治疗作用,因此,其开发难度很大程度上受靶蛋白成药性的影响,诸如靶蛋白是否有合适的“口袋”结构等。根据Nature Reviews Drug Discovery的报道,在人类基因编码的超过20000个蛋白质中,可成药的蛋白仅有3000个,超过80%的蛋白质为非疾病相关蛋白或不能被目前常规的小分子药物和生物大分子药物所靶向的蛋白,属于不可成药靶点;在可成药的3000个蛋白中,目前也仅有 700个蛋白质相对应的治疗药物被成功研发出来。随着新靶点的开发难度越来越高,小分子药物和抗体药物的研发难度也不断提升,而成熟靶点相关的药物赛道将变得日益拥挤。
小核酸类药物是基于碱基互补配对原理,通过干扰翻译过程实现对基因表达的调控,无需与靶点蛋白质直接结合。因此,理论上任何由特定基因错误表达引起的疾病都可以通过小核酸药物进行治疗,这为小核酸药物的开发提供了丰富的候选靶点,使其突破了传统小分子化药和抗体类药物面临的限制。
(2)研发周期短
DNA 测序技术的发展和成熟使得疾病相关的基因序列信息能够快速、准确地获取,而在知道靶基因的序列之后,即可进行小核酸药物的序列设计。这种主动的、明确的、有针对性的药物设计摆脱了传统药物的大规模筛选周期,大大缩短了药物开发的时间。以此次新冠疫情中Moderna公司mRNA疫苗的前期开发过程为例,COVID-19的核酸序列于2020年1月11日公布,Moderna在1月13日即完成mRNA疫苗序列的研究工作,2月7日完成首批样品制备,3月3日开始I期临床,3月16日即完成了首例患者给药,其前期开发速度远高于传统的疫苗。
(3)药效持久
整体而言,小核酸药物的有效作用时间比传统的小分子和蛋白药物更长。以siRNA药物为例,当靶标mRNA被降解后, RNA诱导的沉默复合体(RISC)可以循环工作,参与下一轮靶标mRNA的降解。因此,小核酸药物可在细胞内实现较长时间的药效作用,降低给药频率,提高患者治疗的依从性。较长的作用周期使得小核酸药物在糖尿病、心血管疾病等慢性病领域具有竞争优势。
(4)特异性强
传统的小分子和抗体药物与靶点的结合是结构驱动的,具有相似结构的蛋白质将影响药物的特异性。而小核酸药物与靶标的结合是序列驱动的,通过碱基互补配对识别特定目标序列,具有最小的或至少可预测的脱靶效应。因此,小核酸药物也具有相对更高的特异性。
(5)临床开发成功率高
小核酸药物以明确的疾病相关的核酸序列为目标,其针对性的设计避免了研发过程的盲目性,使得研究结果的确定性更强,临床开发的成功率也更高。以小核酸药物领域的龙头企业Alnylam为例,其研发项目从I期临床进展到III期临床的开发成功率达到 59.2%,而根据《Clinical Development Success Rates 2006-2015》的统计,创新药从I期临床进展到III期临床的平均成功率仅为11.2%。
图2 小核酸药物的研发成功率远高于创新药整体
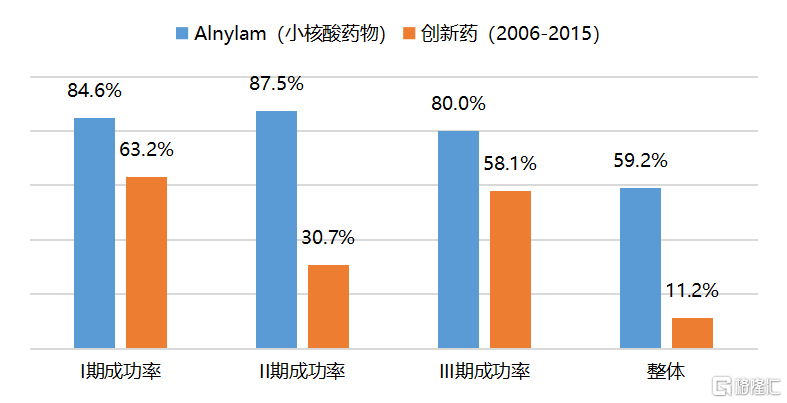
资料来源:Alnylam,《Clinical Development Success Rates 2006-2015》,国泰君安证券研究
表2 小核酸药物与小分子药物、抗体和基因治疗药物相比优势明显

资料来源:Sirnomics,国泰君安证券研究
二、多年曲折发展,小核酸药物终迎发展新纪元
2.1
小核酸药物经历了曲折的发展过程
从1978年ASO的概念首次被提出,到如今小核酸药物不断商业化落地,其发展过程可分为三个阶段:
(1)探索发现期(1970s-2005年)
1978年,哈佛大学科学家Paul Zamecnik等人首次利用ASO技术成功抑制了Rous肉瘤病毒的复制,拉开了小核酸药物开发的序幕。1985年,硫代磷酸修饰方法的开发,提升了反义核酸的稳定性和递送效率,同时RNase H依赖的反义核酸作用机制得到解析,推动了ASO药物的临床应用进程。1998年,第一款ASO药物获批,同年,RNAi的作用机理被揭示,小核酸药物研发热情高涨,罗氏、默克、辉瑞、赛诺菲、雅培等巨头纷纷进入这一领域。
(2)曲折发展期(2005-2016年)
这一时期,由于稳定性、免疫原性和递送系统的问题,小核酸药物的研发和商业化屡遭挫折。全球首个获批的ASO药物Vitravene因销售额过低而退出市场;多个ASO药物接连在临床研究中失败;siRNA药物也面临体内不稳定性和潜在的免疫原性等问题。2009~2013年,小核酸药物的发展陷入低谷,大型药企和资本纷纷离场,诺华和罗氏中止了和Alnylam的合作,辉瑞和雅培也中止了RNA药物的研究项目。2013年,全球第二个ASO药物Mipomersen(针对用于治疗纯合子家族性高胆固醇血症)的获批,让人们看到了行业复苏的希望。
(3)快速发展期(2016年-今)
随着前期研发的积累,这一时期,小核酸药物在化学修饰和递送技术等领域取得关键性突破,小核酸药物领域的龙头企业也进入收获期。2016~2018年,Ionis和Sarepta Therapeutics公司的多款ASO药物相继获批。2018年,Alnylam公司开发的治疗周围神经病变的siRNA药物Patisiran 获FDA批准,成为全球第一个获批的siRNA药物。根据弗若斯特沙利文的数据,目前全球有近80个小核酸药物进入临床研究阶段,整个行业也进入了发展的新纪元。
图3 小核酸药物在曲折中发展
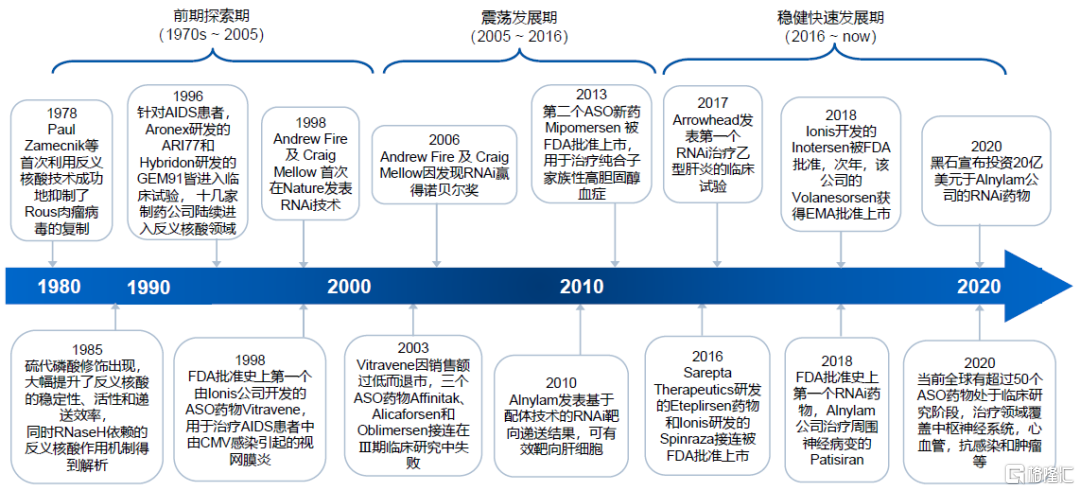
资料来源:弗若斯特沙利文
2.2
多款潜力药物上市,资本和药企加速布局
2.2.1
潜力产品不断获批,市场规模高速增长
目前,全球共有14款小核酸药物款获批上市,包括4款siRNA、9款ASO、1款Aptamer,其中80%的产品为2015年以后上市,已上市小核酸药物大部分所针对的适应症为遗传性疾病。从竞争格局来看,Ionis、Alnylam和Sarepta是小核酸药物三巨头,三者独立研发或与其他企业合作研发上市的产品多达12个,占已获批产品的比例达到86%。目前,国内企业尚无产品获批上市。
表3 已上市的小核酸药物汇总
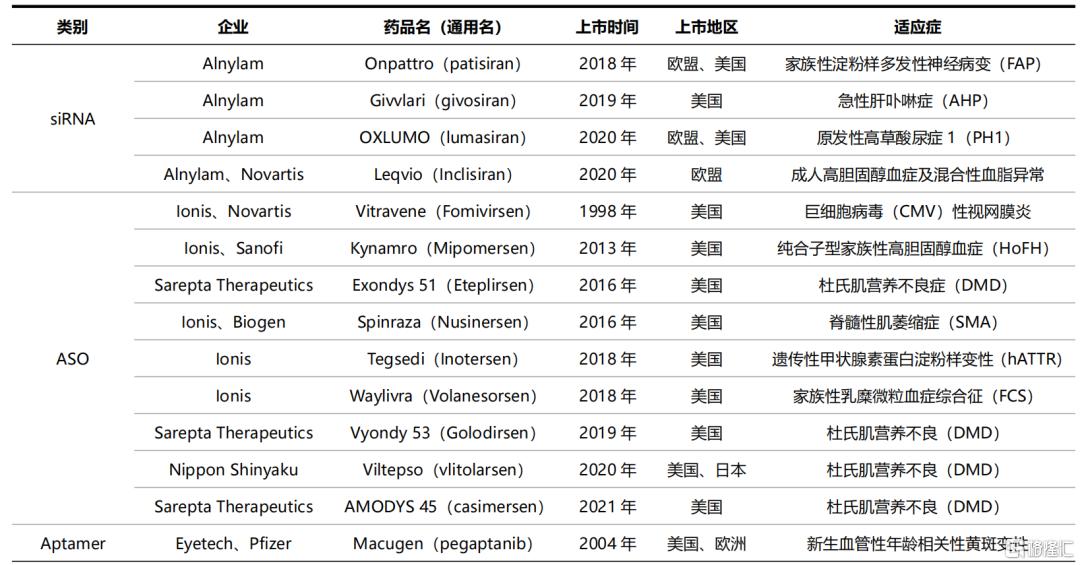
资料来源:药链圈,国泰君安证券研究
从全球几款重磅小核酸药物的销售额来看,2019年全球小核酸药物的市场规模已超过26亿美元。由于目前上市的小核酸药物主要适应症均为罕见病,患者群体数量有限,因此其整体市场规模还相对较小。随着针对代谢性疾病、感染、癌症等患者群体的更广泛适应症药物不断落地,未来几年,小核酸药物市场将快速增长,预计2025年全球小核酸药物销售额将突破100亿美元。据药链圈预测,2030年我国小核酸药物市场规模也将突破100亿元。
图4 小核酸药物竞争格局(获批产品数量占比)
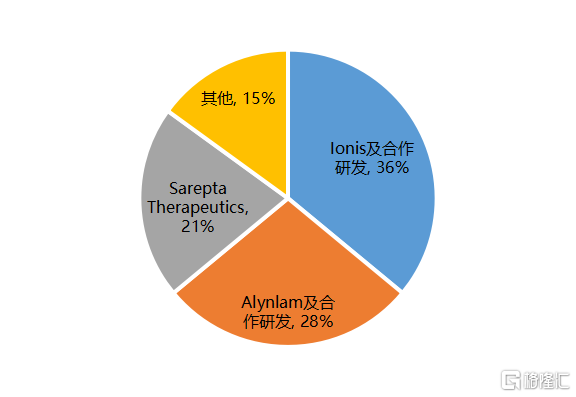
资料来源:国泰君安证券研究
图5 全球小核酸药物市场规模快速增长(亿美元)
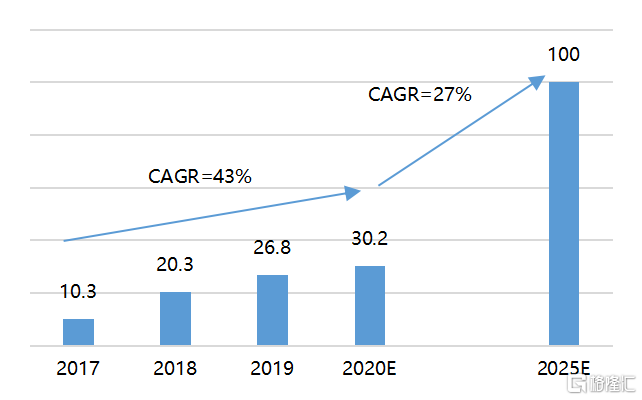
资料来源:《RNA therapeutics on the rise》,国泰君安证券研究
2.2.2
在研管线快速跟进,适应症领域不断拓宽
随着修饰和递送等关键问题的突破,小核酸药物的开发效率迅速提升。据弗若斯特沙利文统计,截至2020年12月,全球进入临床阶段的小核酸药物研发管线接近80个,其中10个进入了临床III期,大多数集中在临床I期和II期;此外,全球还有超过400个小核酸药物研发管线处于临床前研究阶段。全球小核酸药物开发企业可分为两类:一类是以Ionis、Alnylam、Arrowhead、Sarepta、Dicerna等为代表的致力于小核酸技术研发和创新的公司,他们在成立时即专注于这一领域,经历了长期的研发积累,拥有自主的核心技术平台,在产品研发进度和管线丰富程度上处于行业领先地位;另一类是以罗氏、阿斯利康、诺华、GSK等为代表的医药巨头,由于具有雄厚的资金实力,出于效率方面考虑,更多是通过合作研发、授权引进等方式快速布局这一领域。
图6 全球临床阶段的管线数目超80个
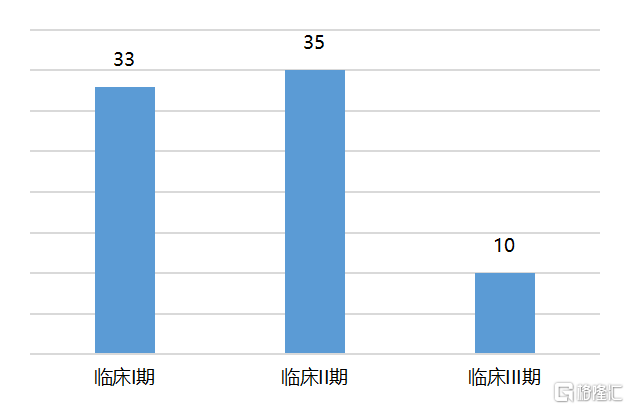
资料来源:弗若斯特沙利文,国泰君安证券研究
注:截至2020.12
图7 Ionis、Alnylam、Arrowhead管线布局领先

资料来源:弗若斯特沙利文分析,国泰君安证券研究
注:截至2020.12
表4 医药巨头通过授权引进和合作研发快速进入小核酸领域(不完全统计)
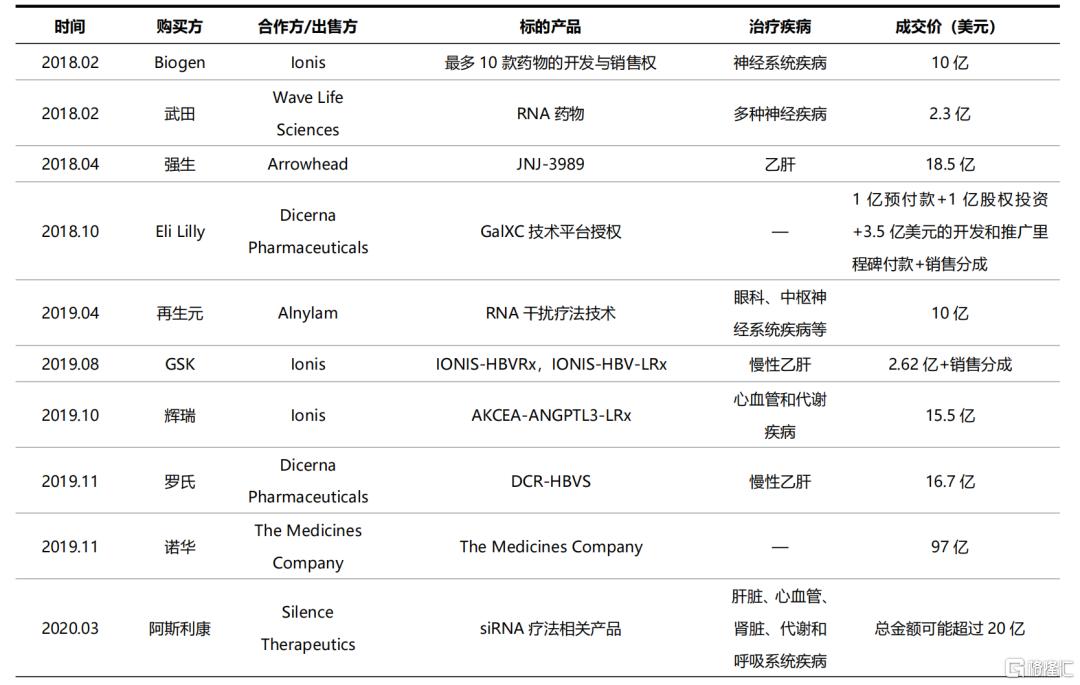
资料来源:国泰君安证券研究
目前,国内致力于小核酸药物研发的创新型企业有十余家。通过合作研发和自主开发相结合的方式,国内小核酸企业迅速成长。截至2021年7月,共有7款国内企业的在研小核酸药物管线进入临床阶段(不包括mRNA疫苗),其中3款ASO药物、4款siRNA药物。
表5 国内多家企业小核酸药物管线进入临床(不包括mRNA疫苗)
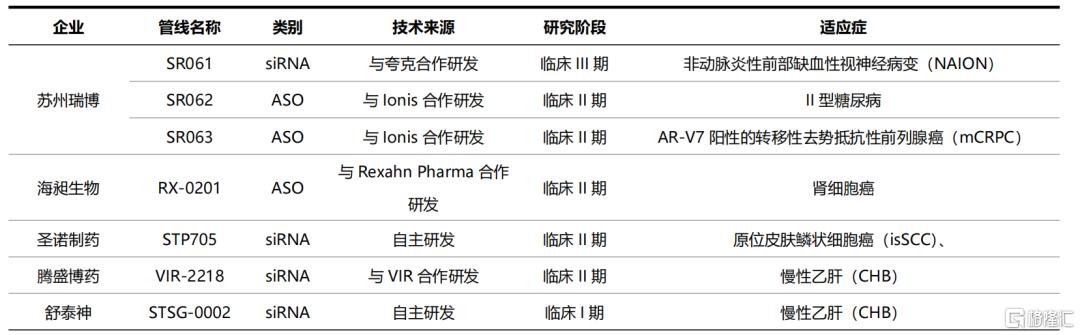
资料来源:公司官网,国泰君安证券研究
从在研管线的治疗领域统计数据来看,小核酸药物的适应症正在不断拓宽,重点治疗领域包括杜氏肌营养不良、癌症、囊性纤维化等。其中,杜氏肌营养不良占比达到25%,癌症占比为10%,口腔修复科占比为7%;其他治疗领域,如神经系统疾病、代谢疾病、传染病等也均有布局。未来,随着适应症领域的拓宽,特别是针对肿瘤、代谢疾病等大患者群体的小核酸药物落地,小核酸药物市场将进入高速增长阶段。
图8:小核酸药物治疗领域不断丰富

资料来源:华经产业研究,国泰君安证券研究
2.2.3
资本助力,加速小核酸药物商业化进程
近年来,技术的突破、产品的陆续落地以及巨大的潜在市场空间使得小核酸药物深受资本青睐。根据Wind数据,海外上市的小核酸药物公司自2016年1月至2021年1月市值的平均增幅达到580%。2018年上市的Moderna 和2019年上市的BioNTech两家mRNA疫苗研发企业市值亦呈爆发式增长,2021年8月底分别突破1600亿美元和900亿美元。
表6 小核酸药物上市企业市值快速增长(不包含mRNA企业)
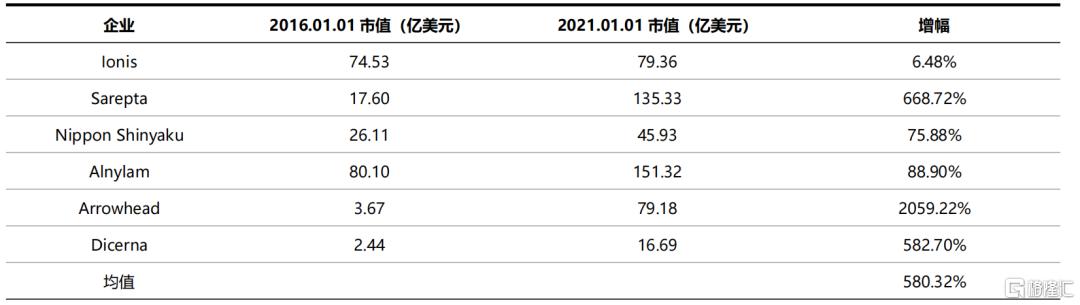
资料来源:Wind,国泰君安证券研究
在一级市场,小核酸药物初创企业也不断获得大额融资。医药魔方数据显示,2021年1~6月,全球RNA疗法领域共发生28起投融资事件,总投资金额超10亿美元,另有18项企业之间的项目和技术交易合作。尽管国内企业目前尚无产品获批,但资本普遍看好该行业国内市场未来5~10年的增长潜力,知名机构纷纷布局这一赛道。近两年,国内小核酸领域投融资事件频发。2021年上半年,国内至少9家小核酸药物企业获得投资,资本的助力将加速小核酸药物的研发和商业化进程。
表7 国内小核酸创新企业2020~2021年频获大额投资
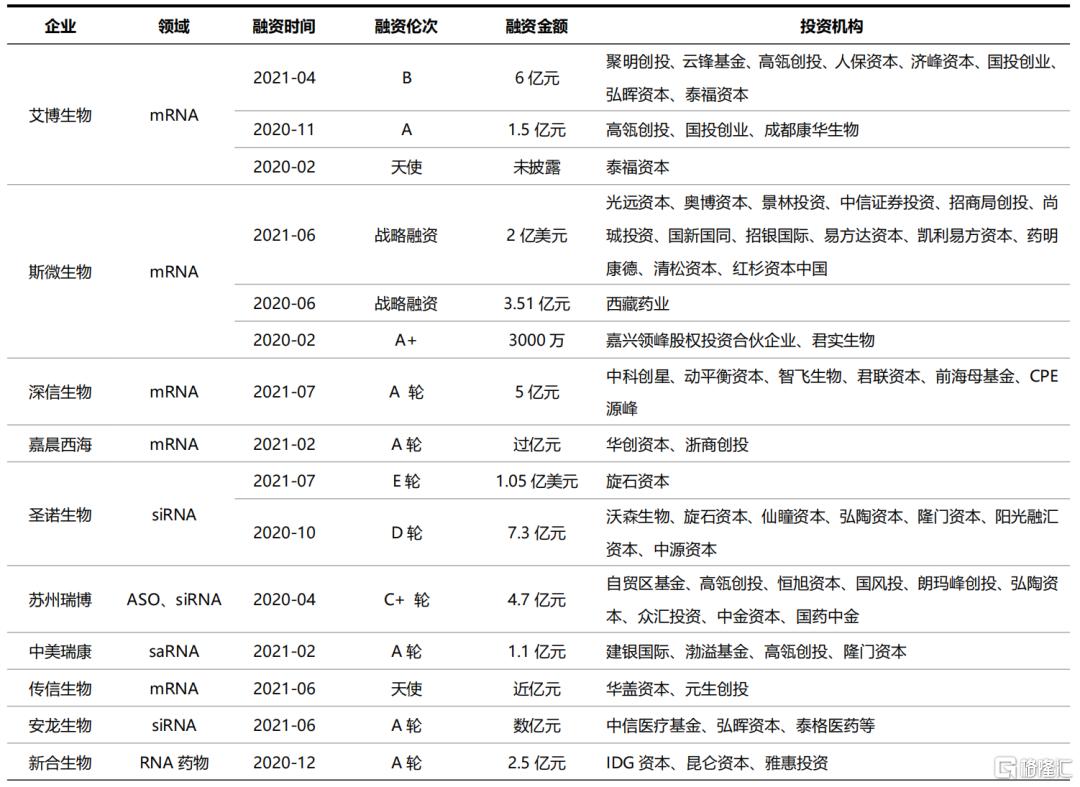
资料来源:Wind,医药魔方,国泰君安证券研究
三、不同机理均获突破,多条路径并驾齐驱
3.1
ASO药物:发展迅速,获批药物最多
1978年ASO技术诞生后,ASO药物发展迅速,无论是基础科学研究还是商业化进程,均领先其他类型核酸药物。从1998年首个ASO药物获FDA批准,到目前获批的ASO药物已达到9款,成为小核酸领域获批药物最多的一个类型。
3.1.1
ASO药物作用机理
ASO是一种单链寡核苷酸分子(18~30nt),可以是DNA、RNA或DNA/RNA的杂合单链,进入细胞后可通过多种机制调节基因表达。ASO药物包括RNase H依赖型与空间位阻型两种机制:
(1)RNase H介导的RNA的降解
RNase H(核糖核酸酶H)是一种核糖核酸内切酶,内源性RNase H能够特异性识别并切断杂交到DNA链上的RNA的磷酸二酯键,即能特异性降解RNA-DNA杂交链中的RNA链,进而沉默靶基因的表达。经典的RNase H依赖型ASO药物通常遵循Gapmer模式,即一个基于DNA的中央“间隙”被基于RNA的侧翼区域包围(如下图a所示),ASO中DNA序列和靶序列结合后即可招募RNase H介导RNA的降解。由于RNase H在细胞质和细胞核中都是活跃的,因此基于此机理的ASO药物可以靶向细胞核内转录本,例如未成熟的pre-mRNA和lncRNA,从而间接调控蛋白的合成。在已获批的ASO药物中,Fomivirsen、Mipomersen和Inotersen均为RNase H依赖型药物。
(2)形成空间位阻,阻碍蛋白翻译
基于空间位阻机制的ASO药物可以与转录本中的特定序列结合,从而阻碍或干扰mRNA、miRNA或Pre-mRNA发挥其正常功能,既可上调基因表达也可下调基因表达。首先,空间位阻型ASO最广泛的应用是与pre-mRNA结合,改变剪接体的剪接位置,从而选择性地排除或保留特定的外显子(外显子跳跃或外显子包含),如下图b所示;其次,ASO也可以通过靶向并结合目标mRNA的AUG起始密码子,从而中断翻译,如下图c所示;此外,ASO还可靶向上游开放阅读框(uORFs):ORFs从起始密码子开始,结束于终止密码子,是DNA中具有编码蛋白质潜能的连续的碱基序列。由于密码子读写起始位点的不同,mRNA序列可能按六种ORF阅读和翻译。一些转录本包含uORFs,可调节初级开放阅读框(pORF)的翻译活动,而使用ASO药物靶向uORF会破坏这一调控,激活pORF翻译,如下图d所示。在已获批的ASO药物中,Eteplirsen、Golodirsen和Nusinersen均为空间位阻机理。
图9 ASO药物作用机理多样
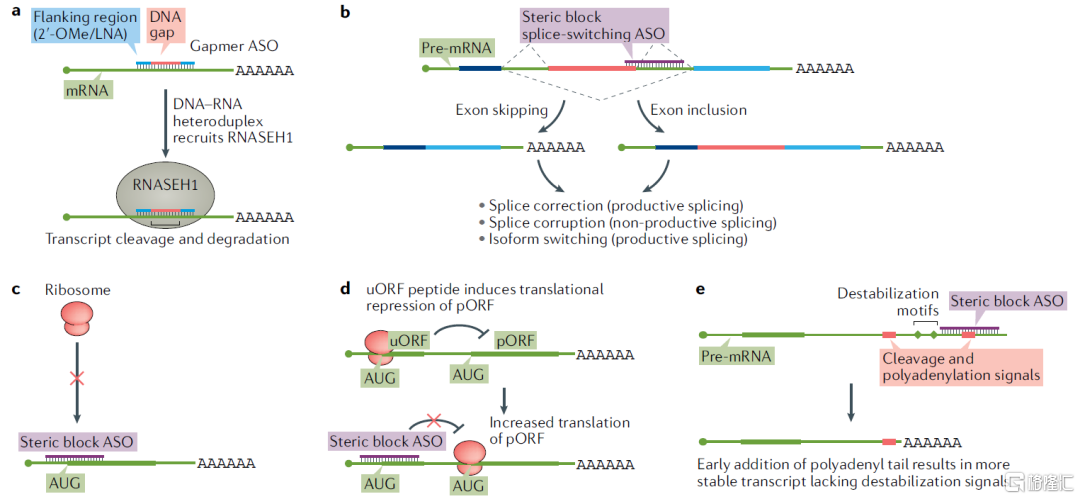
资料来源:《Advances in oligonucleotide drug delivery》
3.1.2
Ionis和Sarepta为ASO药物领头企业
ASO药物经过一定的化学修饰之后,其在体内的稳定性、免疫原性、半衰期等均有所改善,因此其对递送系统的依赖程度相对较低,这也是ASO药物早期发展较快的原因之一。尽管如此,ASO药物行业的进入门槛仍然较高,全球处于实验室阶段之后的项目不足300个,治疗领域主要集中于肿瘤、神经与肌肉疾病。从ASO药物竞争格局来看,行业集中度较高, Ionis、Sarepta两家公司经过较长时间的研发积累,在ASO化学修饰方面形成了专利和技术护城河,成为该领域的领头企业。
(1)Ionis:ASO药物龙头企业
Ionis Pharmaceuticals成立于1989年,公司搭建了一种高效的ASO研发平台。目前已批准上市的9种ASO药物中,Ionis占据了5个。其中,Ionis和Biogen开发的针对脊髓性肌萎缩症(SMA)的Nusinersen是ASO药物中的明星产品,于2016年获批,已经在50多个国家上市,尽管价格高昂,但需求不断增长,2019年销售额已经突破20亿美元,为小核酸药物领域销售额最高的产品。同时,Ionis在研管线布局非常丰富,截至2021年8月,进入临床阶段的管线有39个,治疗领域涵盖了心肾疾病、代谢性疾病、神经系统疾病、感染性疾病、癌症、眼部疾病、血液疾病等。
Ionis在化学修饰、递送技术等核心技术方面进行了完备的专利布局,已经形成完整成熟的技术体系。通过结构设计和化学修饰,其药物可以实现静脉注射、皮下注射、口服、髓鞘内注射等多种给药方式。公司也在持续地优化其化学修饰技术以进一步提高药物的稳定性、亲和力、特异性、对特定组织和细胞的靶向性等。此外,Ionis也有自己的核心递送技术LICA(Ligand Conjugated Antisense),LICA可将一个Ligand与核酸药物相连接,使ASO可以通过该Ligand与特定的细胞受体结合,实现靶向递送。正是得益于其核心技术平台和专利布局,Ionis可通过技术和产品的对外授权或合作开发获得非常可观的授权费用或销售分成。
图10 Inios多个管线处于临床阶段
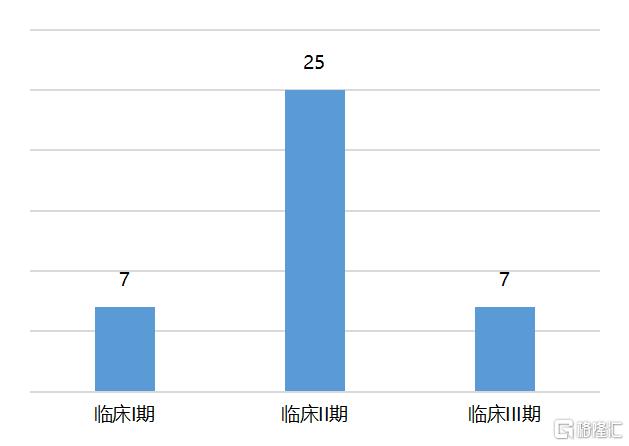
资料来源:Ionis,国泰君安证券研究
图11 Ionis管线覆盖多个疾病领域
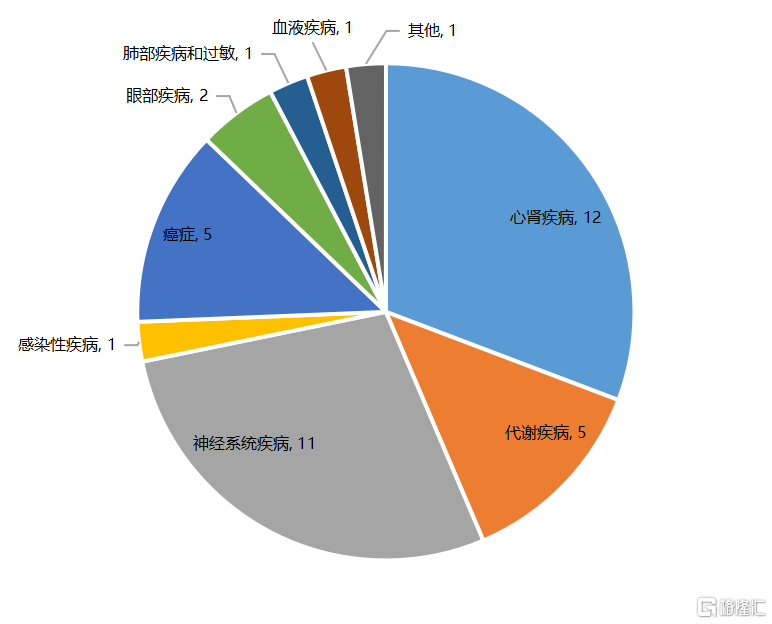
资料来源:Ionis,国泰君安证券研究
(2)Sarepta——杜氏肌营养不良症领域的王者
Sarepta成立于1980年,是一家全球性生物技术公司。公司布局ASO、基因编辑、基因治疗等多个技术平台,目前已经有3款ASO药物获得FDA批准上市,分别为Eteplirsen、Golodirsen、Gasimersen,均用于治疗不同类型基因突变的杜氏肌营养不良症(DMD)。同时,Sarepta基于不同技术平台布局了近40个在研管线,主要针对肌肉领域的各类罕见病。
Sarepta的核心技术之一为PMO(磷酸二酰胺吗啉代寡聚体)化学修饰技术平台和外显子跳跃技术,主要用于空间位阻机制的ASO药物开发,以增强ASO药物的亲和力和稳定性,公司已获批上市的ASO药物均使用PMO进行化学修饰。
公司目前正在开发第二代技术PPMOs(Peptide phosphorodiamidatemorpholino oligomers),即在PMO的基础之上添加一个具有靶向功能的多肽,用于增加药物组织的渗透性。PPMO修饰的ASO可以提高药物在骨骼肌、心肌、平滑肌等组织的递送效果,扩大其可能治疗的疾病范围。
图12 Sarepta公司在研管线进度情况
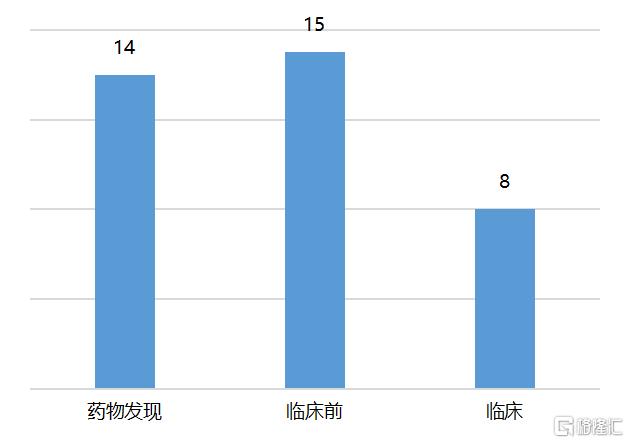
资料来源:Sarepta,国泰君安证券研究
图13 Sarepta公司在研管线基于多样化的技术平台
资料来源:Sarepta,国泰君安证券研究
3.2
siRNA药物:高效持久,潜力巨大
从1998年RNAi现象被科学家发现后,全球范围内迅速掀起了siRNA药物研发热潮。但受限于当时基因测序、递送技术尚不成熟,药物的免疫原性和毒副作用等问题无法攻克,siRNA药物的开发遭遇困境。伴随着理论研究的深入以及药物递送等关键技术的突破,siRNA药物近年来再次受到广泛关注,成为小核酸药物领域的研究热点。2018年8月,FDA批准了全球首个siRNA药物Patisiran,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)伴多发性神经病变,预示着siRNA药物的发展步入了新阶段。相较于其他类型的小核酸药物,siRNA药物具有更加高效且药物作用周期更长的优势,未来潜力巨大。
3.2.1
siRNA的作用机理
siRNA通常为含有20~25个碱基对的短双链RNA片段。当dsRNA药物进入细胞内后,核酸内切酶Dicer和TRBP共同作用将其切割成多个具有特定长度和结构的小片段siRNA,随后其与AGO2等结合,形成siRNA诱导沉默复合体(siRNA-induced silencing complex,siRISC),siRISC中的siRNA经AGO2作用分解成两条单链,正义链被释放出去,反义链则留在siRISC中;仅含反义链的siRISC被激活,在反义链的引导下通过碱基互补配对原则与靶标mRNA结合,诱导靶标mRNA降解,从而抑制蛋白的表达。
图14 siRNA药物作用机理
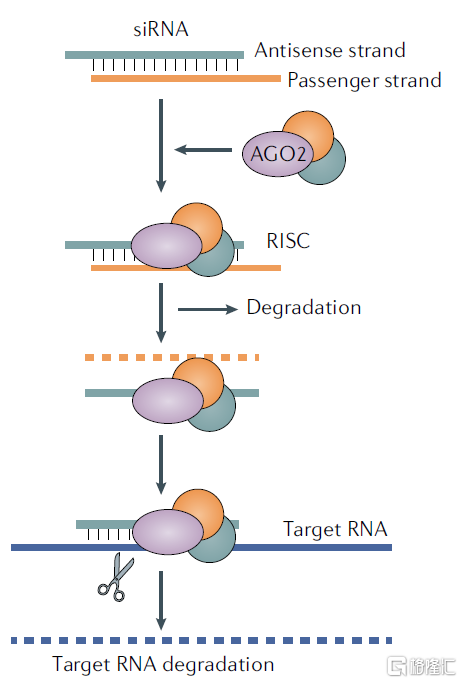
资料来源:《Advances in oligonucleotide drug delivery》
与ASO相比,siRNA药物的优势主要体现在:
(1)理论上siRNA药物的药效作用更持久
当一个基因沉默过程完成后,靶标mRNA被释放,siRISC将与另一个靶标mRNA结合,开始诱导新一轮的基因沉默,这一过程可循环多次。因此,siRNA药物在细胞内可实现更加持久的基因沉默效果。
(2)siRNA可以做到更高效
双链siRNA进入细胞内形成siRISC后,经AGO2作用解开成两条单链,反义链留在siRISC中诱导靶标mRNA沉默,正义链被释放出去。被释放的正义链可能很快被降解,同时也可以作为引物,在RNA依赖的RNA聚合酶的催化下以靶mRNA为模板扩增得到dsRNA,dsRNA又被Dicer降解成siRNA进入RNAi循环,诱导基因沉默,从而使得siRNA药物的效果级联放大。
而另一方面,siRNA也存在其自身的局限性:
(1)不能作用于细胞核内的转录本
ASO的作用机理之一是招募RNase H诱导靶标RNA的降解,RNase H在细胞质和细胞核中均活跃存在,因此ASO药物可以靶向和沉默细胞核内转录本。而由于RISC普遍存在于细胞质中,因此siRNA无法针对细胞核内的转录本发挥沉默效果。
(2)siRNA对递送系统要求更高
除了同样面临血液中的稳定性和免疫原性问题外,由于siRNA为双链结构,疏水碱基对未暴露且亲水性更强,故较难穿过细胞膜而被摄取。因此,与ASO药物相比,siRNA对递送系统有更高的要求和更强的依赖。
(3)潜在的脱靶效应
ASO药物对应的RNAase H只有在完全互补配对的情况下才可能发挥作用,序列特异性很高。而siRNA对应的AGO2酶只需要8个核苷酸的种子序列匹配即可诱导降解,易发生miRNA样脱靶效应。
3.2.2
Alnylam:siRNA药物领域的领先者
Alnylam成立于2002年,一直专注于siRNA药物的研发,是该领域的领先企业。公司所研发的针对FAP的药物patisiran是全球第一款获批的siRNA药物,目前全球已经获批的4款siRNA药物均来自Alnylam。与此同时,公司拥有丰富的研发管线,其中有4个管线已进入后期临床阶段(II~IV期),6个管线进入早期临床阶段(IND~II期),治疗领域覆盖了遗传病、代谢疾病、感染性疾病、中枢神经系统疾病以及眼科疾病等。
Alnylam在小核酸的化学修饰、核酸序列设计以及药物递送技术等方面都有深厚的积累,先后开发了多种核酸修饰技术、多代siRNA序列模板设计技术以及两项药物递送系统:脂质纳米粒子递送平台(LNP)和GalNAc递送平台。同时,公司也在开发新一代的修饰和递送技术,以增强药物的特异性和治疗窗口,扩大药物的治疗领域。
得益于其先进的技术平台,Alnylam在小核酸药物的研发上具有超高的效率和极高的成功率。Alnylam预计,从目前到2025 年,公司每年将有2~4个研发项目可以递交IND申请。此外,Alnylam的研发项目从I期临床进展到III期临床结束的成功率达到54.6%,远远高于创新药开发的行业平均值。
图15 Alnylam公司的在研管线
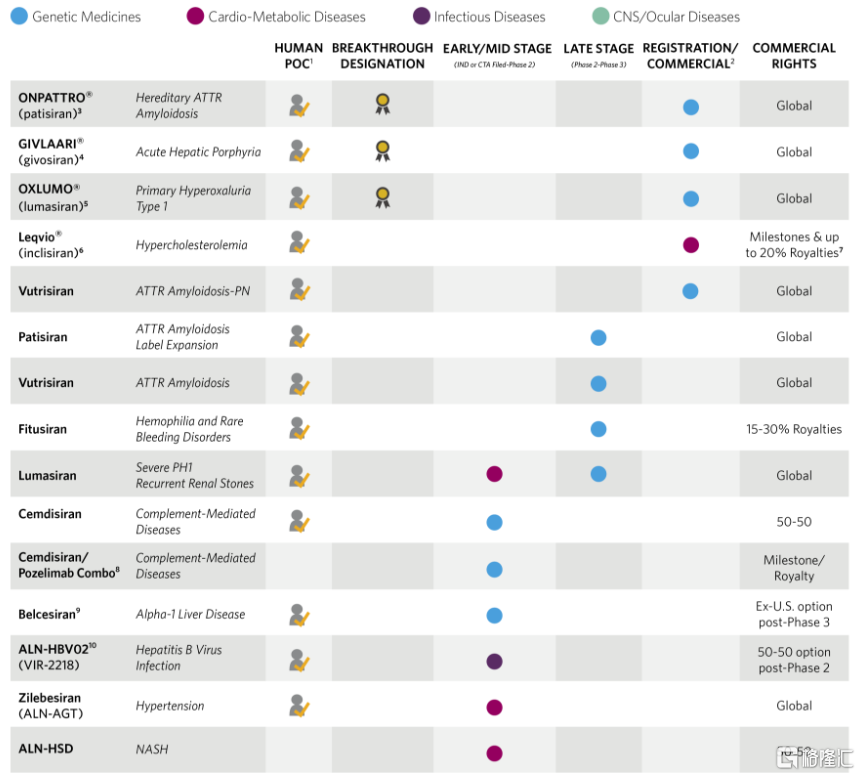
资料来源:Alnylam
3.3
miRNA药物:调节多种mRNA翻译
miRNA是一类内生的、长度约为15~25个核苷酸的小单链RNA,1993年首次在线虫中被发现。miRNA本身不编码蛋白质,但其可以与靶mRNA互补结合,调节靶mRNA的翻译过程,目前,在人体内已经发现约2000种miRNA。由于miRNA识别靶mRNA并不需要完美的碱基配对,一个miRNA可以同时调节多个转录本的翻译,而几个miRNA也可以调节同一个转录本,据推测,miRNA调节着人类超过三分之一的基因表达。研究发现,许多miRNA在人类疾病的发病机制中发挥重要作用,如肿瘤、肝炎、心血管疾病等,因此miRNA也成为开发针对这些疾病药物的一个重要思路。miRNA复杂而又精细的调节机制导致miRNA药物的研发难度较高,目前尚未有miRNA药物获批上市,但已有较多管线进入临床试验阶段。
3.3.1
miRNA药物的作用机理
在细胞中,成熟的miRNA分子可与AGO蛋白家族形成miRNA诱导沉默复合体(miRISC),通过碱基互补配对结合并降解靶mRNA,诱导基因沉默。根据药物作用机理不同,miRNA药物可分为两类:miRNA拮抗剂(miRNA antagonist)和miRNA类似物(miRNA mimics)。
(1)miRNA 拮抗剂
miRNA拮抗剂有两种设计思路:一种思路为以体内miRNA为靶标,与miRISC中的成熟miRNA结合,阻断下游基因沉默的发生;另一种思路以mRNA为靶标,通过与mRNA结合来占据其与miRISC的结合位点,避免其被降解,进而阻断下游基因沉默。
(2)miRNA类似物
miRNA类似物与人体内miRNA功能类似,可将其导入病理细胞中补充发挥缺失的miRNA的正常生理功能。例如,一些抑制肿瘤相关基因表达的miRNA可能在癌细胞中消失,那么通过相应的miRNA类似物替代治疗策略则可发挥抑癌效果。
与siRNA不同,miRNA是内源性成分,并通过内源性RNAi机制实现基因沉默。因此,理论上人体细胞内引入miRNA药物可具有更好的耐受性,这也是miRNA药物的一个潜在优势。
图16 miRNA药物的作用机理
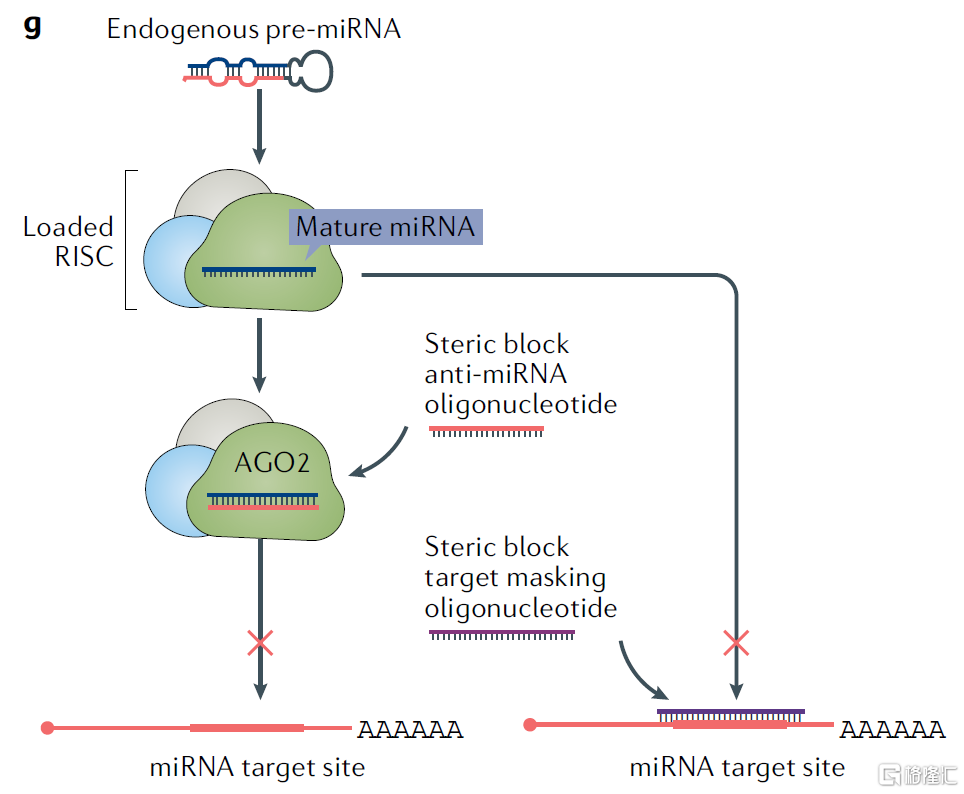
资料来源:《Advances in oligonucleotide drug delivery》
3.3.2
Regulus:专注于miRNA药物开发
Regulus Therapeutics创立于2007年,致力于发现和开发以miRNA为靶标的创新药物。公司建立了丰富均衡的miRNA 药物研发管线,保持着在miRNA领域的领先地位。目前,Regulus针对遗传性肾炎的管线已进入临床II期阶段,针对常染色体显性多囊的管线已进入临床I期阶段。此外,公司还正在进行针对感染、肝脏疾病等领域的miRNA药物开发。
图17 Regulus公司研发管线

资料来源:Regulus
3.4
saRNA药物:通过上调基因表达发挥作用
2006年,加州大学圣地亚哥分校的华裔科学家李龙承博士在全球首次揭示了人类细胞中存在小dsRNA诱导转录激活的现象,并将该现象命名为“RNA activation”,即RNA激活。2014年,英国MiNA Therapeutics公司获得了李龙承实验室有关RNA激活技术的开发权益。短短两年后,该公司宣布全球首个saRNA药物进入临床试验,用于肝癌治疗。saRNA作为一种新的疾病治疗思路,在生命健康领域具有广阔的应用前景。
3.4.1
saRNA药物的作用机理
saRNA是由约21对核苷酸构成的双链RNA,其结构与siRNA较为类似,但功能却不同。saRNA在细胞质中与AGO2蛋白结合后会移除正义链,形成saRNA-AGO2复合物,然后进入细胞核招募RHA和CTR9形成RNA介导的转录激活复合物(RITA,RNA induced transcriptional activation),随后复合物中反义链会和对应基因启动子/增强子等区域的靶序列结合,通过RNA聚合酶II的作用增强相应基因的表达,进而达到治疗疾病的目的。
这种通过“做加法”来实现疾病治疗的全新思路被认为在肿瘤、遗传代谢病等重大疾病领域具有巨大的应用前景。例如,saRNA可通过作用于抑癌基因启动子的特定序列来上调或激活抑癌基因的表达,达到抑制癌细胞的增殖、侵袭和迁移的效果。
图18 saRNA药物的作用机理
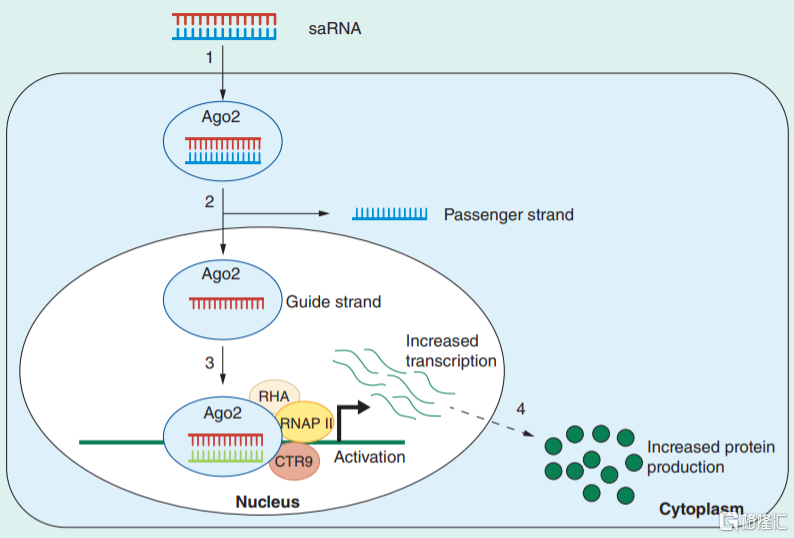
资料来源:《Developing small activating RNA as a therapeutic: current challenges and promises》
但同时,saRNA药物的独特作用机制也导致其开发难度要高于siRNA等其他小核酸药物。一方面,saRNA的作用靶标为基因的启动子区域,这就决定了saRNA药物必须进入细胞核才能发挥作用,其对递送技术的要求更高;另一方面,由于DNA缠绕在组蛋白上,以核小体的形式存在,因此saRNA药物的靶点并非全完暴露,且DNA又是双链的,这都将影响saRNA与靶点的顺利结合,saRNA药物的发展也因此相对缓慢。
3.4.2
MiNA Therapeutics:全球首家开发saRNA疗法的企业
MiNA Therapeutics成立于2008年,是全球第一家开发saRNA药物的公司。在2014年取得saRNA基础专利后,公司在2016年便开始了全球第一款saRNA药物的临床研究。目前,MiNA Therapeutics共有5个在研产品,其中针对肿瘤的管线MTL-CEBPA的两种联合疗法已处于临床I/II期阶段,分别为与索拉非尼联用治疗肝细胞癌(HCC),以及与帕博利珠单抗联用治疗晚期实体瘤。2020年5月,MiNA公布了MTL-CEBPA联合索拉非尼治疗HCC的Ib期剂量递增和队列扩展研究的顶线数据,试验达到了安全性和耐受性的主要终点。此外,公司有另外三个管线处于药物发现阶段。
图19 MiNA Therapeutics公司研发管线
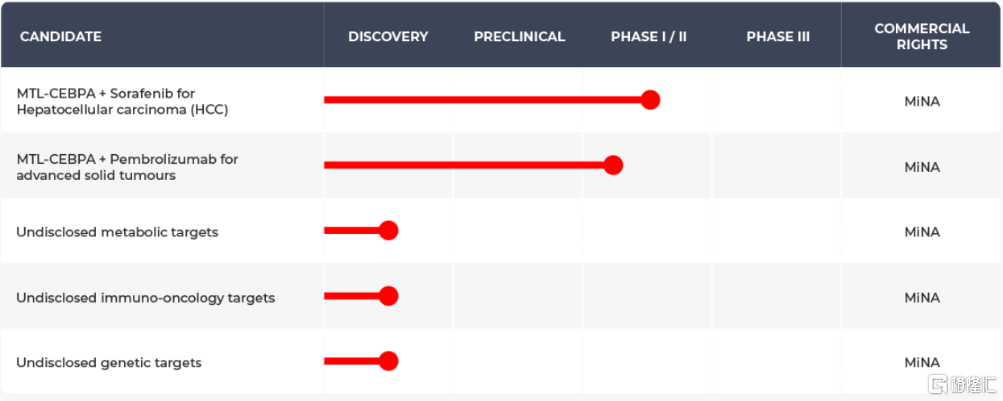
资料来源:MiNA Therapeutics
MiNA独特的saRNA技术平台也吸引了众多医药巨头与之合作。2017年,勃林格殷格翰与MiNA达成合作,二者将共同开发非酒精性脂肪性肝炎和其它纤维化疾病的saRNA疗法;2020年,阿斯利康也宣布将与MiNA在代谢性疾病领域展开研究合作;2021年,法国知名药企Servier宣布与MiNA建立研究伙伴关系,就神经系统疾病共同合作开发saRNA疗法。
3.5
Aptamer:通过三维结构结合靶标分子
Aptamer技术最早于1990年由L. Gold和J. Szostak提出。Gold研究组运用体外筛选技术获得了能与T4 DNA聚合酶特异性结合的RNA分子,并将其所运用的寡核苷酸配体筛选方法定义为配体指数富集的系统进化技术(the systematic evolution of ligands by exponential enrichment process),简称SELEX。此后,虽然Aptame在实验室研究中不断突破,但其商业化的临床应用一直未能广泛开展起来。迄今为止,全球仅有Pegaptanib一款Aptamer药物获批,用于治疗新生血管性年龄相关性黄斑变性(wAMD),其商业化也遇到了较大阻碍。
3.5.1
Aptamer药物的作用机理
Aptamer是折叠成独特三维结构的短单链寡核苷酸,其可以是DNA也可以是RNA,通常是20~70个核苷酸,DNA aptamer稳定性更高,RNA aptamer具有更多的动态结构,更加灵活。与ASO、siRNA、miRNA和saRNA等药物的作用原理不同,Aptamer借助静电、氢键、范德华力、疏水作用等非共价作用力形成能够与靶标分子相作用的结合口袋和裂隙,并通过这些特殊的三维立体结构,高亲和力和特异性地识别并结合靶分子,发挥类似于抗体或化学抑制剂的功能,其特异性和结合亲和力可达到抗体水平。Aptamer的靶标选择范围很广,包括蛋白质、小分子、金属离子、病毒、细菌和全细胞等。
图20 Aptamer识别靶标分子

资料来源:南京大学官网
Aptamer通常用SELEX技术进行筛选:先构建长度在20~100个核苷酸的随机寡核苷酸序列文库,将其与靶标孵育一定时间后,移除未结合的分子,而结合的寡核苷酸序列在洗脱后经PCR扩增形成新的文库,该过程重复8~20次即可筛选出高特异性和高亲和力的Aptamer。
图21 SELEX筛选技术示意图
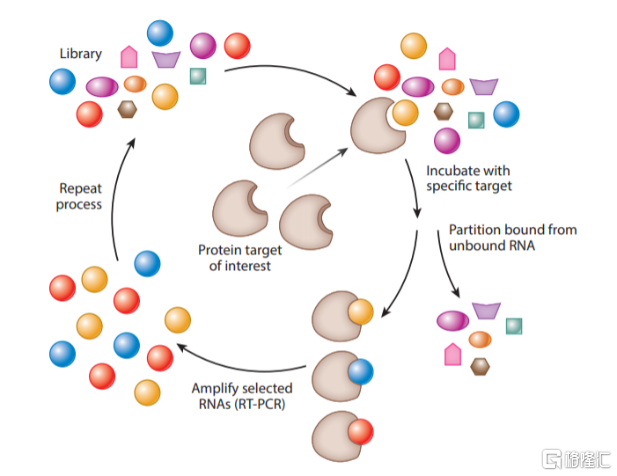
资料来源:《Aptamers as Therapeutics》
由于与抗体药物发挥类似的效果,Aptamer药物经常被拿来与抗体药物进行比较。与单抗相比,Aptamer具有诸多优点。 一方面,Aptamer的筛选和确认均在体外进行,不依赖于细胞、动物甚至体内条件,且其大规模生产不需要组织培养和血清纯化等步骤,一旦确定序列后,即可以通过寡核苷酸合成方法实现精准重复和大规模制备,重复性好,稳定性高,成本低,周期短;另一方面,Aptamer的靶分子范围极广,除了蛋白之外,还包括糖类以及其他小分子,通过Cell-SELEX技术可以筛选出病原微生物、肿瘤细胞等多种细胞表面的未知分子标志物作为靶点。Aptamer药物最大的局限性在于其体内稳定性,Aptamer作为小分子核酸在体内很容易被核酸酶破坏清除,半衰期短,因此需要通过修饰来提升其稳定性。短期来看,Aptamer药物可能还无法与目前种类众多、治疗领域不断丰富的抗体药物抗衡,其商业化进程也面临来自抗体药物的巨大竞争压力。但同时,人们也开始关注Aptamer在药物递送和疾病诊断领域的潜在应用价值。Aptamer可以通过linker与蛋白、小分子药物、核酸药物、毒素和光敏物质连接,在药物靶向递送和分子成像等领域具有较大的应用潜力。此外,Aptamer拥有类似抗体特异性结合力,可开发出多样化的免疫诊断试剂盒。目前,已有识别HER3、OX40、CD137、VEGF的RNA aptamer用于癌症检测,其在IVD领域应用前景广阔。
图22 Aptamer作为药物载体
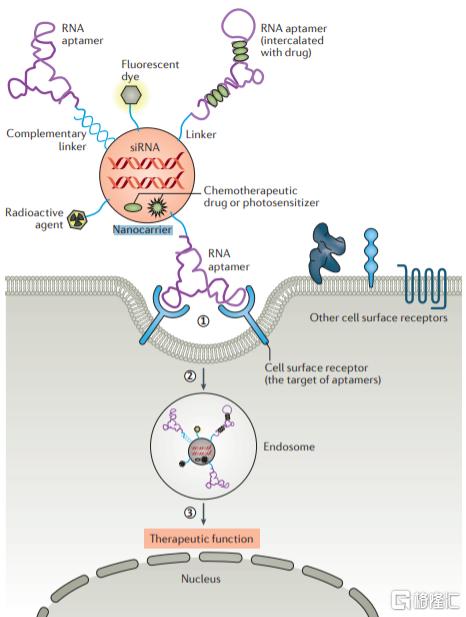
资料来源:《Aptamers as Therapeutics》
3.5.2
NeXstar:迄今唯一成功开发Aptamer药物的企业
NeXstar是最早研究Aptamer药物的企业之一,成功开发了目前全球仅有的一款Aptamer药物Pegaptanib(其临床试验由Eyetech和辉瑞合作进行)。1999年,NeXstar被吉利德收购。Pegaptanib靶向VEGF165,于2004年获FDA批准上市,用于新生血管性年龄相关性黄斑变性的治疗,2005年销售额达到1.85亿美元。戏剧性的是,随着针对同适应症的抗体类药物Lucentis、Avastin、Eylea的上市和推广,Pegaptanib面临巨大的竞争压力,迅速失去市场,2006年的销售额降至500万美元,2008年销售额仅为120万美元。
除了NeXstar之外,德国的NOXXON Pharma公司在Aptamer药物领域亦有广泛布局。与行业内其他致力于研究常规Aptamer药物的企业不同,NOXXON公司专注于一种较为特殊的Aptamer药物——Spiegelmers,即镜像寡核酸链或L型寡核酸链。L型核酸是与天然D型核酸(DNA或RNA)呈镜像对称的核酸分子,由于L型核酸难以被天然存在的各类核酸酶降解,这意味着它可以在不经过任何修饰的情况下拥有较高的稳定性,具有较长的半衰期。目前,NOXXON针对II型糖尿病、系统性红斑狼疮以及各类实体瘤的Aptamer研发管线已进入临床研究阶段。
图23 NOXXON公司Aptamer药物研发管线
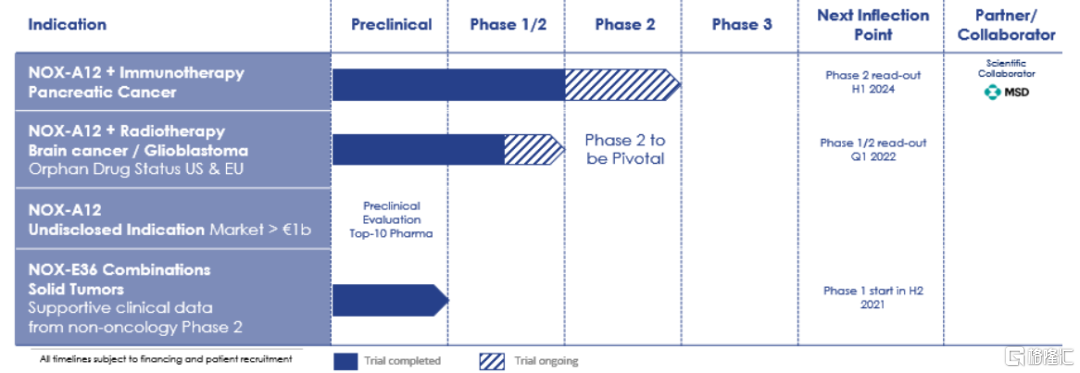
资料来源:NOXXON
3.6
mRNA药物:疫苗领域的明日之星
1990年,Wolff等首次报道肌内注射mRNA到小鼠骨骼肌实现了编码蛋白的表达。此后,基于mRNA的治疗方法在疫苗、肿瘤免疫治疗、蛋白替换和细胞基因工程等领域被广泛研究。在本次新冠疫情中,mRNA疫苗彰显了巨大优势和平台化能力,打破了诸多质疑,使mRNA药物受到极大的关注。
3.6.1
mRNA药物的作用机理
mRNA疗法主要应用在两个方面:(1)将表达抗原蛋白的mRNA导入体内,即制成传染病疫苗,这是mRNA目前最主要的应用领域;(2)通过外源导入mRNA来纠正基因表达缺陷或异常,即蛋白替代疗法。
针对传染病的mRNA疫苗是指将编码病毒抗原蛋白的mRNA导入人体,在细胞内直接进行翻译,形成相应的抗原蛋白,从而诱导机体产生特异性免疫应答,达到预防免疫的作用。相比于传统疫苗,mRNA疫苗最大的优势在于无需经过毒株筛选、分离、培养、传代等过程,直接利用公布的病毒核酸序列即可开始疫苗研制,且其生产工艺简单,无需细胞培养或动物源基质,合成速度快、成本低,非常适合应对大规模突发新型传染病。在此次新冠疫情期间,Moderna和BioNTech的新冠疫苗在III期临床试验中的保护率分别高达94.1%和95%,其开发速度快、保护率和安全性高的特点迅速吸引了全球医药产业界的关注。此外,针对病毒变异,mRNA疫苗只需对核酸序列进行修改,其灵活性要远高于灭活疫苗和重组蛋白疫苗。mRNA疫苗为平台型技术,一旦突破了递送方面的挑战,即可基于同一递送系统开发不同系列的疫苗。目前,针对流感、寨卡、狂犬病等其他病毒的mRNA疫苗也在快速研发之中。
治疗性的肿瘤mRNA疫苗可分为两类:基于树突状细胞(DC)给药的mRNA疫苗和直接注射进体内的mRNA疫苗。基于DC细胞的mRNA疫苗类似于体外的“基因疗法”,在体外将肿瘤抗原相关mRNA转染至DC细胞后,在细胞质中翻译形成抗原,与DC细胞作用,激活DC细胞;然后将已激活的DC细胞注入人体,激发体内免疫系统应答,以达到杀死肿瘤细胞的目的。直接注射的mRNA疫苗是通过一定的给药途径或递送体系,将编码肿瘤相关抗原的mRNA导入患者体内,从而刺激机体产生抗体,抑制肿瘤细胞生长。目前,mRNA肿瘤疫苗已被广泛研究,应用于包括前列腺癌、急性骨髓白血病、转移黑色素瘤、肺癌等多种类型的肿瘤,多个管线已进入临床试验阶段。
图24 mRNA新冠疫苗原理
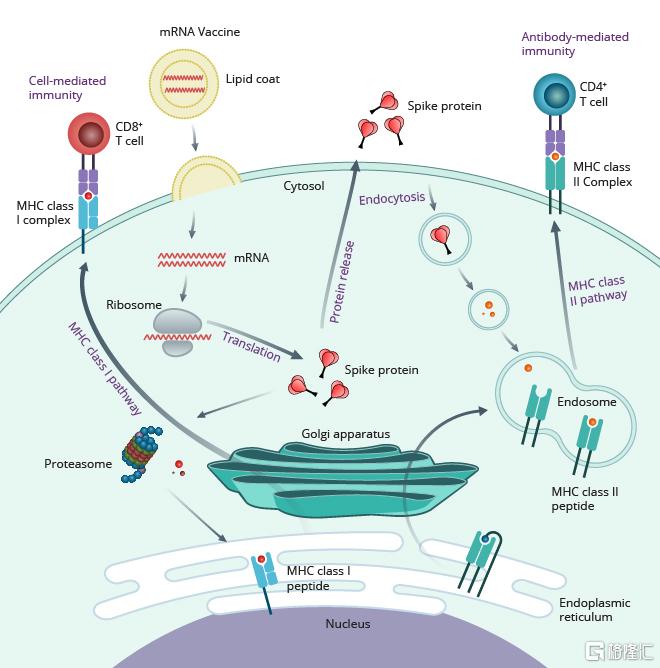
资料来源:《Meet the mRNA vaccine rookies aiming to take down COVID-19》
蛋白替代疗法也是mRNA的一个潜在应用领域。理论上,mRNA可编码体内任何一种蛋白,其作为蛋白替代疗法正在探索中。例如,通过导入编码抗体的mRNA进行免疫治疗,目前已有多款相关产品进入临床前或临床阶段。相比传统的抗体药物,mRNA药物具有其独特优势。首先,mRNA在体内的翻译可持续数天,有望降低给药频率;其次,mRNA 可以进入到细胞内编码针对细胞内靶点的抗体,而大分子抗体很难进入细胞内;最后,通过序列设计,mRNA可以编码多种抗体,理论上通过一次给药即可达到抗体联用的效果。但同时,基于mRNA的蛋白替代疗法也存在一定的局限性,例如mRNA本身的不稳定性、免疫原性等;此外,蛋白替代疗法需要在翻译后对蛋白进行修饰,不同细胞的修饰过程和结果可能不同,因此需要将mRNA精准递送至正确的细胞中才能发挥相应的效果,这对递送系统的要求很高。
据中国食品药品网资讯,目前全球累计有超过150种mRNA药物及疫苗的研发管线,其中47%应用于传染病领域,30%应用于肿瘤治疗领域,17%应用于蛋白质替代以及基因治疗。
3.6.2
Moderna、BioNTech:mRNA双雄
(1)Moderna:专注mRNA疗法,研发管线丰富
Moderna成立于2010年,2018年在纳斯达克上市。公司拥有自主完整的mRNA技术平台,包括mRNA修饰改造、LNP递送系统和生产平台。同时,Moderna也是研发管线最为丰富的mRNA制药企业之一,目前共有23条mRNA药物在研管线,包括9个预防性疫苗、4个系统分泌和细胞表面疗法、2个癌症疫苗、3个瘤内注射产品、1个局部再生疗法及4个系统细胞内疗法。目前,Moderna共有15个管线进入临床开发阶段,其中针对巨细胞病毒(CMV)感染的mRNA-1647、肿瘤疫苗mRNA-4157和针对心衰及心脏病的AZD8601三个管线进展最快,均已进入II期临床阶段。此外,公司新冠mRNA疫苗已获批上市。
图25 Moderna在研管线
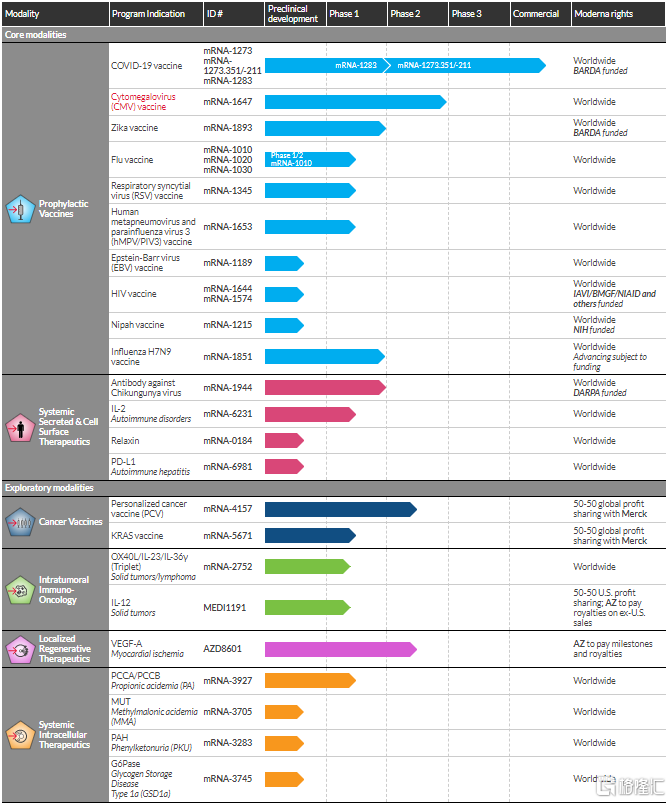
资料来源:Moderna
(2)BioNTech:技术平台多样,肿瘤管线突出
BioNTech成立于2008年,2019年在纳斯达克上市,公司致力于开发更精确、更个性化的免疫疗法。除mRNA技术平台外,BioNTech还拥有抗体技术平台、小分子技术平台以及细胞疗法平台等。在mRNA技术平台方面,其FixVac平台主要针对癌症免疫疗法,RiboMabs平台主要针对重组抗体替代疗法,RiboCytokines是针对细胞因子替代疗法。此外,公司还通过和Genevant合作获得了LNP递送技术。
BioNTech目前已有1个研发管线进入临床II期阶段、11个管线进入临床I期研究,其mRNA研发管线以肿瘤相关产品为主,覆盖了头颈鳞癌、黑色素瘤、前列腺癌等多个适应症。其中,BioNTech与Genentech联合开发的个性化mRNA肿瘤疫苗iNeST(BNT122)进展最快,黑色素瘤适应症已进入II期临床阶段,多发性骨髓瘤适应症已进入I期临床阶段。此外,公司新冠mRNA疫苗已获批上市。
图26 BioNTech研发管线
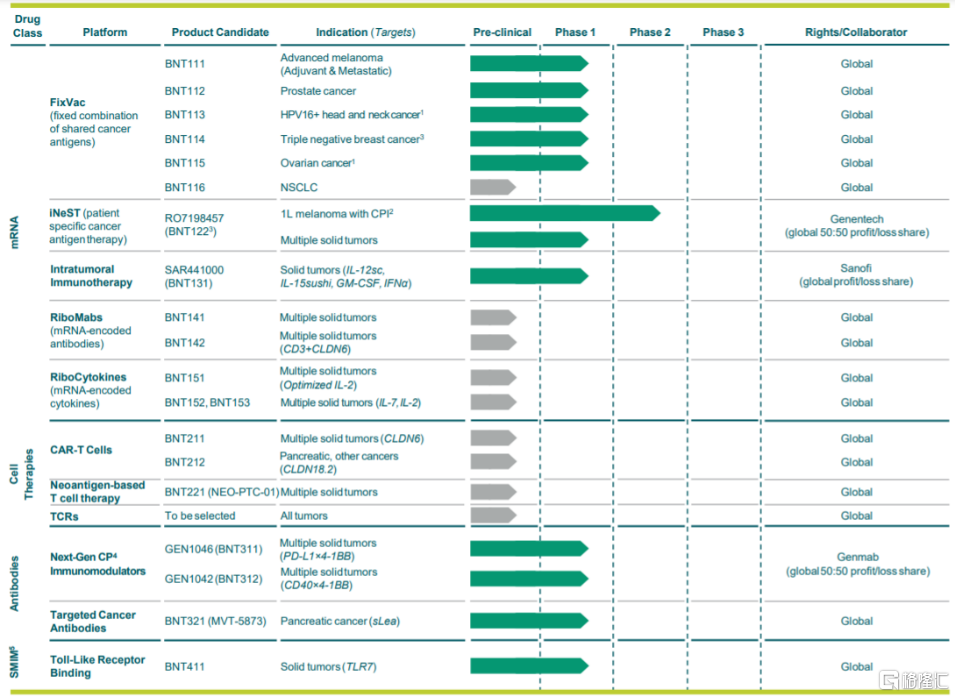
资料来源:BioNTech
四、化学修饰和递送系统是小核酸药物开发的关键
外源的核酸药物从进入体内到发挥药效作用需要克服多个难题:(1)稳定性问题,易被快速排出至体外或被体内的核酸酶降解;(2)免疫原性问题,会激活人体免疫系统的反应;(3)组织靶向问题,会在许多非药物活性部位的组织中积累,并产生毒性;(4)细胞摄取问题,核酸药物分子结构较大、亲水性高,且带有负电荷,穿透细胞膜的难度较高;(5)内体逃逸问题(endosome escape),核酸分子进入细胞后需要从内体中逃逸进入细胞质才能发挥作用。化学修饰和递送系统是解决上述问题的关键策略,这两项技术的突破对小核酸药物的发展起到了至关重要的作用,也将在很大程度上影响小核酸药物未来的发展前景。
图27 小核酸药物在体内经历的路径
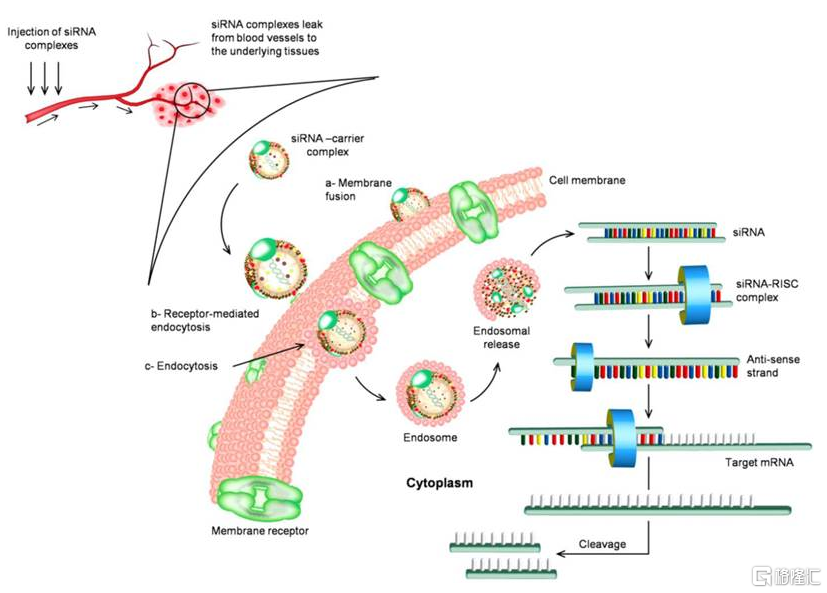
资料来源:《Nanoparticle-Mediated Systemic Delivery of siRNA for Treatment of Cancers and Viral Infections》
4.1
化学修饰:增强核酸药物稳定性的基础
对于小核酸药物进行化学修饰可以达到两个主要效果:首先,化学修饰可减弱生物体先天免疫机制对RNA药物的免疫反应,降低药物的免疫原性;其次,可增强RNA药物抵抗内源性内切酶和外切酶降解的能力,提高RNA的稳定性,延长药物半衰期。
根据不同的修饰位点,目前常用的核苷酸化学修饰技术包括磷酸骨架修饰、核糖修饰、核糖五元环改造、碱基修饰、核苷酸链末端改造等。
图28 核苷酸的化学修饰策略

资料来源:《Advances in oligonucleotide drug delivery》
(1)磷酸骨架修饰
针对磷酸骨架最常用的化学修饰是硫代磷酸(PS),即将核苷酸中磷酸骨架的一个非桥氧用硫进行替代。PS修饰基本不影响核酸药物的活性,但可以抵抗核酸酶的降解,而且该改造可增强其与血浆蛋白的结合能力,降低肾脏清除速率,提高半衰期,改善药物的药代动力学。PS是第一代ASO药物中常见的化学修饰,现在依然被广泛应用于小核酸药物的开发。
PS修饰一个主要缺点是每个PS修饰都会产生两种具有不同空间取向的立体异构体,因此PS修饰的寡核苷酸实际上是外消旋体的混合物,而这两种不同取向的分子具有不同的药代动力学和药效学特征。通常来说,分子的异质性和不均一性不利于其临床开发,因此发展具有立体选择性的PS修饰技术成为未来的一个突破方向。例如,Wave Life Sciences公司已经开发了一种可扩展的方法来合成在每个PS链上都具有固定立体化学结构的寡核苷酸。PS修饰的另一个缺陷是会降低寡核苷酸对其靶标结合的亲和力,这一限制可以通过合并其他类型的修饰来弥补。
(2)核糖修饰
对核糖结构的修饰属于第二代化学修饰技术。寡核苷酸在核糖2’端的羟基(-OH)可以被甲氧基乙基(MOE)、甲氧基(OMe)、氟(F)等取代,用于降低免疫原性,增加对核酸酶的耐受力,改善血浆的稳定性,进而延长药物半衰期。例如,2’-MOE修饰可以将小核酸药物的清除半衰期延长至2-4周,并提高其与靶向mRNA的结合能力以及效力,降低细胞毒性;2’-OMe修饰可提高药物稳定性,并一定程度上提高药效和降低免疫原性;2’-F修饰可提高药物与靶向mRNA的结合能力但不能提高稳定性,更适用于RISC机制的siRNA药物。
值得注意的是,核糖2’端修饰与RNase H活性不兼容,因此其不常用于RNase H依赖型的ASO药物,而更多用于空间位阻型的ASO或Gapmer ASO的侧翼序列。此外,由于AGO2对结构的选择性限制了可以使用的化学修饰类型,2’-MOE修饰通常也不被纳入siRNA药物的设计中。
(3)核糖五元环改造
对核糖的五元环进行改造被归为第三代化学修饰,包括LNA(锁核酸,locked nucleic acid)、PNA(肽核酸,peptide nucleic acid)、PMO(吗啉代寡核苷酸,phosphoroamidate morpholino oligomer)等。LNA是经典的核苷酸桥接修饰技术,其通过核苷酸第2和第4个碳原子之间的桥连而将其构象固定,增强了药物对核酸酶的抗性以及对靶mRNA的亲和力。但LNA导致的构象改变使核苷酸与RNase H不相容,因而更多地被用于Gapmer ASO的侧翼区域或空间位阻型ASO。此外,LNA修饰的RNA药物在部分临床中观察到了肝毒性与肾毒性,其后续发展需继续关注。PNA和PMO改造可以增强核酸药物对核酸酶的抵抗、提高亲和力和特异性等。但PNA和PMO为电中性,与血浆蛋白结合能力较弱,因此容易通过肾脏排泄迅速清除,半衰期较短。对于PMO修饰,还需注意的是其主链包含手性中心,因此PMO修饰的核酸药物也是外消旋体混合物。
(4)碱基修饰
小核酸药物对碱基改造的耐受性相对较差,已上市的产品中鲜有采用这一修饰手段。但企业对于碱基修饰也在不断尝试中,例如,5’-Methylcytidine(甲基胞苷)与5’-Methyluridine(甲基尿苷)修饰可以提高药物与靶mRNA的结合能力,降低免疫原性;嘧啶的甲基化可提高寡核苷酸熔解温度,提高药物稳定性和与靶mRNA的结合能力,通常被应用于ASO药物中,而Ionis公司正在开发的ASO药物均有所使用。
(5)末端改造
核苷酸的末端改造主要是为了避免核苷酸链被核酸外切酶降解,例如,在3’端添加反式胸苷(inverted thymidine),或者在末端添加软脂酸或偶联芳香化合物。
特定的化学修饰对提高药物安全性和有效性至关重要,迄今为止,FDA批准的RNA靶向药物几乎均进行了化学修饰。
图29 FDA批准的小核酸药物的化学修饰类型(截至2020.10)
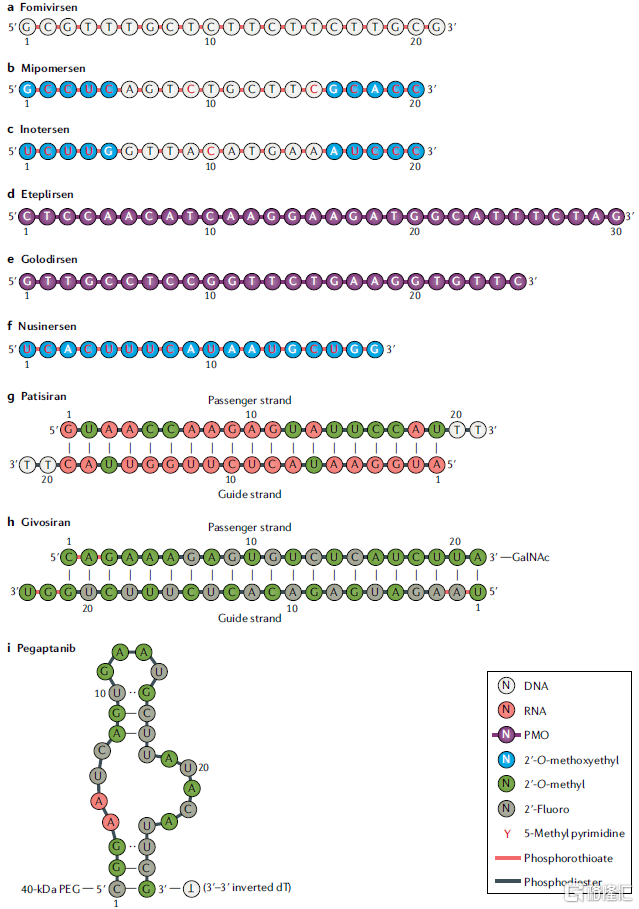
资料来源:《Advances in oligonucleotide drug delivery》
4.2
递送系统:提升靶向性和生物利用度的关键
化学修饰能够在一定程度上解决小核酸药物稳定性和免疫原性的问题,延长药物的半衰期。但小核酸药物要想发挥药效作用,还需在病灶部位富集、通过跨膜转运进入细胞内、实现内体逃逸进入细胞质,这些过程都是制约小核酸药物发展的主要瓶颈,而递送系统则是突破上述瓶颈的重要途径。对于核酸药物,递送系统的功能主要有两个:(1)药物靶向,即将药物精准递送至病灶组织;(2)药物控释,即确保药物进入正确的空间并在合适的时间释放,发挥药理作用。
递送系统可分为病毒载体和非病毒载体两个大类,病毒载体在基因治疗中应用较多,但由于其免疫原性、安全性以及载药量的限制,在小核酸药物中应用较少。根据不同的材料,目前针对小核酸药物开发的非病毒载体可分为脂质类、聚合物类和特定靶向配体类。
4.2.1
脂质类递送系统
脂质类载体是目前研究最多的递送系统,早在1995年,第一个基于脂质的药物制剂Doxil(一种抗肿瘤抗生素)即获批上市。在小核酸药物领域,2018年全球第一个被批准上市的siRNA药物Patisiran以及疫情期间获批的mRNA疫苗都是采用脂质类的递送系统。根据性质和结构的不同,脂质类递送系统可主要分为脂质体(liposome)和脂质纳米颗粒(LNP,lipid nanoparticle)。
(1)脂质体
脂质体是由磷脂组成单层或多层的囊泡状结构,在小分子药物的递送中被广泛使用。脂质体的磷脂双分子层内部为疏水结构,中间通常为水溶液内核,因此脂质体既可以递送亲水性药物,又可递送疏水性药物。脂质体在体内的稳定性和靶向性等特征可以通过颗粒尺寸、表面电荷、脂质分子成分以及表面修饰(配体或聚合物)进行优化。例如,PEG(聚乙二醇)修饰可提高其在体内的循环时间。目前,基于脂质体递送系统的小核酸药物还处于研发阶段。
图30 典型的脂质体药物递送系统的设计
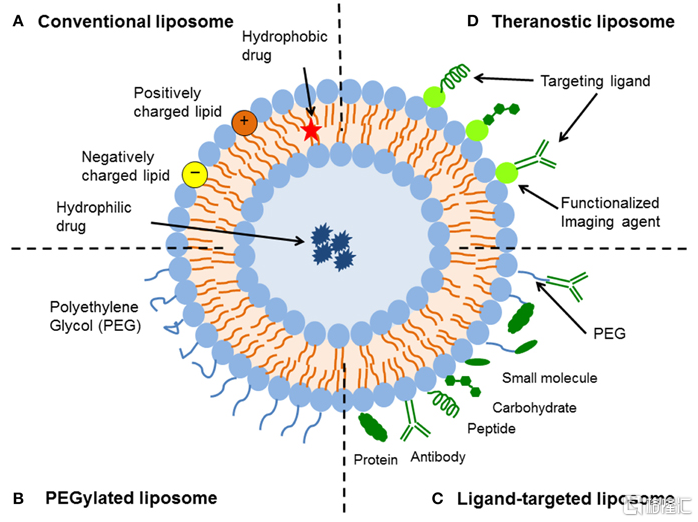
资料来源:《Advances and Challenges of Liposome Assisted Drug Delivery》
(2)脂质纳米颗粒
脂质纳米颗粒(Lipid Nanoparticle,LNP)已在核酸药物中成功应用,也是目前小核酸药物领域研究最多的递送系统之一。与脂质体不同,LNP的结构更为复杂,其内部通常为核酸药物和脂质分子形成的复合物胶束。LNP的成分通常包含中性磷脂、胆固醇、阳离子脂质、可离子化脂质、聚乙二醇脂质等分子。中性脂质是形成膜结构的主要成分;胆固醇可调节磷脂双分子层膜的流动性,使膜通透性降低,减少药物渗漏,同时可维持膜的柔韧性,增强LNP抗击外部条件变化的能力,并对磷脂的氧化有一定保护作用;阳离子脂质一方面能结合带负电的小核酸分子,提高其包载率;另一方面可与带负电的细胞膜作用,促进靶细胞对LNP的摄取。但若阳离子脂质的比例过高,则会激活人体的免疫反应,并在血浆中被快速清除。可离子化的脂质在体液环境中生理pH条件下为电中性,可以避免被清除和过度激活人体免疫反应;当其到达病灶部位,如肿瘤微环境中时,该条件下pH降低、质子化程度升高,使LNP带正电,提升细胞内吞效率;进入细胞内后,进一步质子化,通过质子海绵效应促进内体逃逸。
LNP可进一步被PEG、靶向基团或其分子修饰和功能化。例如,在LNP中掺入PEG-lipid可以延长其在血液中的循环时间,但PEG保护同样会阻碍LNP和细胞膜的相互作用,降低内体效率。因此,在进行PEG修饰时,PEG分子长度和修饰密度的选择是关键。此外,LNP表面还可与特定多肽、Aptamer、抗体等功能性分子进行偶联,赋予其主动靶向功能,促进其在靶组织区域的富集。需要注意的是,对LNP进行修饰会增加其复杂性,这种复杂性可能会带来不可预测的毒性或激发免疫反应,增加其开发难度。
图31 LNP小核酸药物递送系统
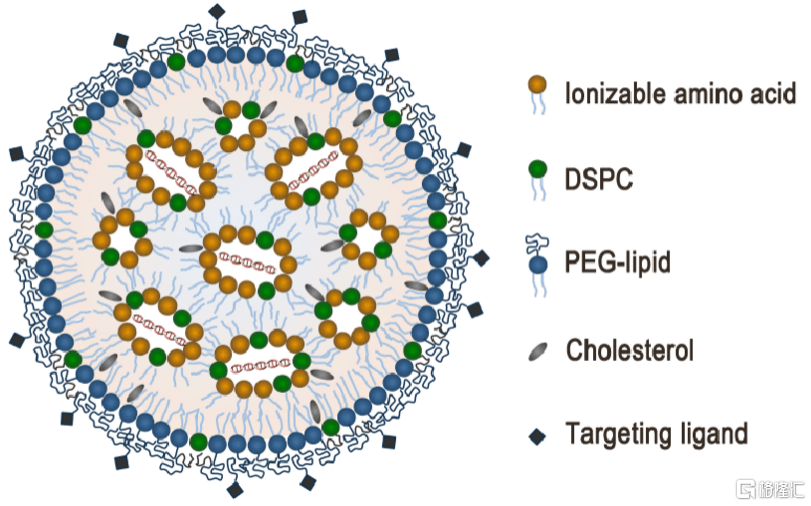
资料来源:《Advances in Lipid Nanoparticles for siRNA Delivery》
4.2.2
聚合物类递送系统
目前,已有多个基于聚合物递送系统的化学小分子药物获得FDA批准。对于小核酸药物,具有阳离子骨架的聚合物可通过静电相互作用包裹核酸分子形成复合物或胶束颗粒,提升小核酸药物在血液中的稳定性、组织富集效果和细胞内吞效率。聚合物递送系统一般可分为两大类:天然聚合物和化学合成聚合物。天然聚合物的优势在于其生物相容性较高,如壳聚糖(chitosan);化学合成聚合物的优势在于其可调节性更高,可通过特定的化学反应调控聚合物分子量、拓扑结构、电荷密度、亲疏水性、刺激响应性等,如聚乙烯亚胺(polyethyleneimine)、树枝状分子(dendrimer)、聚环糊精、聚氨基酸等。同样地,对于聚合物类递送系统,也可在其外围修饰特定的功能性结构,如PEG、靶向基团等,以提高其稳定性和靶向效果。目前,基于聚合物的小核酸递送系统多处于研发阶段。
图32 典型的基于聚阳离子的核酸递送系统
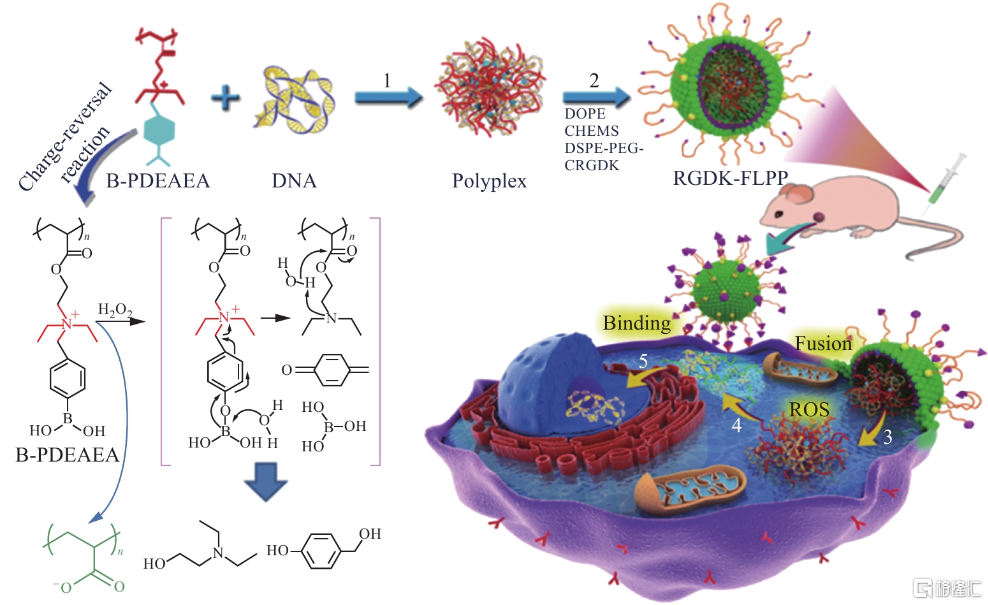
资料来源:《Camouflaging bacteria by wrapping with cell membranes》
4.2.3
配体类递送系统
小核酸药物也可以通过共价结合到特定的配体上,如GalNAc(N-乙酰半乳糖胺),Aptamer、多肽、抗体等,利用配体的性质将药物递送至特定组织和细胞,同时通过连接子(linker)的设计,可实现核酸药物进入细胞后的可控释放。
GalNAc是现阶段最常用也是最成功的配体类递送系统,目前已有3款基于GalNAc技术的小核酸药物获得FDA或EMA的批准。在临床试验阶段的小核酸药物中,约有三分之一管线采用了多价GalNAc递送系统。GalNAc可以与ASGPR(去唾液酸糖蛋白受体)特异性结合,ASGPR是一种内吞性受体,在肝实质细胞表面高度特异性地表达(~500,000/细胞),其与网格蛋白介导的内吞作用可以有效地将药物载体从细胞表面转运至细胞质,同时具有较高的回收循环速率(~15min)。因此,携带小核酸的GalNAc与ASGPR结合后,可将核酸药物顺利带入肝实质细胞内,提高药物靶向性和生物利用度。GalNAc生物相容性高、易生产、稳定性好,且其经皮下给药后循环时间长,药效和持续时间优于静脉给药,未来有望成为靶向肝脏疾病的小核酸药物使用的主要载体类型。目前全球小核酸制药企业中,Alnylam、Ionis、Arrowhead、Dicerna等均开发了各自的GalNAc递送技术平台。
图33 GalNAc在siRNA药物递送中的应用
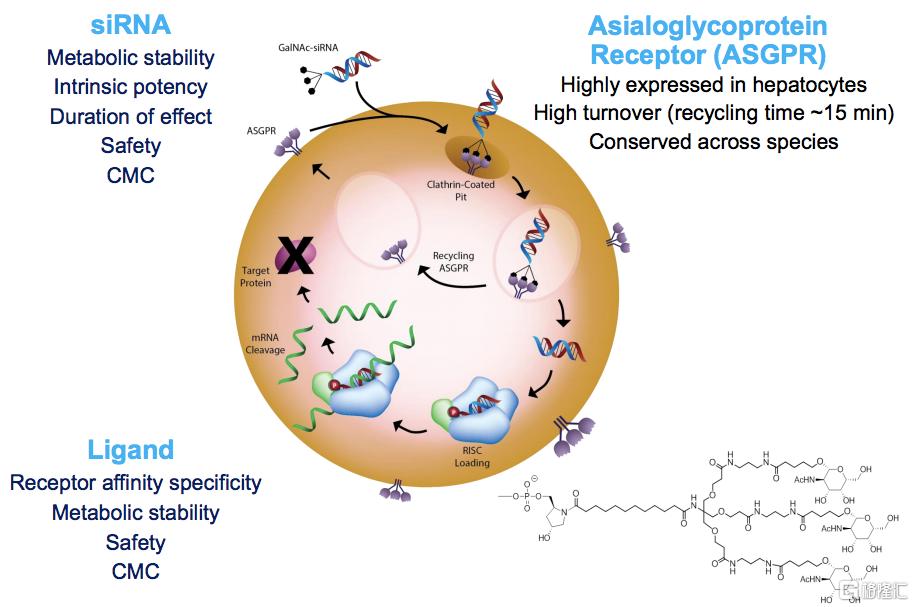
资料来源:Alnylam
除了GalNAc外,其他的配体类递送系统也在临床开发中,包括抗体、适配体、多肽、内源性外泌体、DNA纳米结构等。
图34 其他配体类核酸递送系统
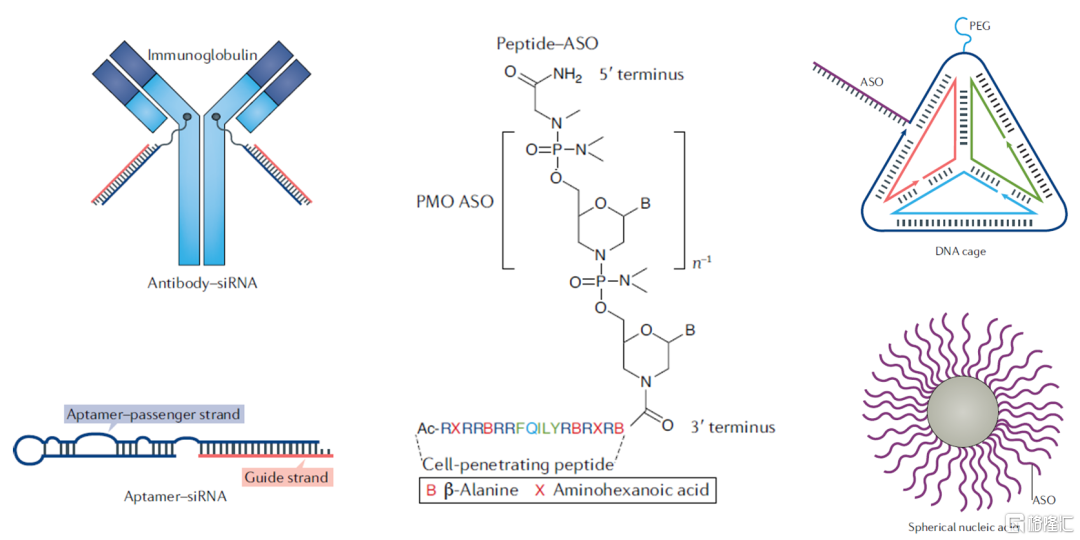
资料来源:《Advances in oligonucleotide drug delivery》
五、小核酸药物开发仍面临诸多挑战
5.1
递送系统仍是制约行业发展的主要瓶颈
(1)内体逃逸效率不高
绝大多数小核酸药物需要进入到细胞质中才能发挥作用,内体逃逸则是递送过程中的关键一步。目前的递送技术在提升核酸药物的稳定性和组织富集度方面取得了重大进展,但在内体逃逸方面却无明显突破。由于内体环境中pH较低,目前多数递送技术会引入pH敏感成分,如可离子化脂质,利用“质子海绵效应”或“胶体渗透压效应”导致膜溶胀,进而释放药物。然而,目前来看,这一机制的效率普遍不高,大部分载体在内吞后仅有0.1-2%的小核酸释放效率。通过对逃逸机制的进一步研究来优化递送系统以提高逃逸效率,对扩大小核酸药物的治疗窗口至关重要。
(2)靶向性较为单一
靶向性的单一导致目前小核酸药物所针对的适应症十分有限。尽管基于LNP和GalNAc的递送系统在肝脏靶向性方面展现出良好的有效性,局部给药途径也解决了部分组织靶向问题,但小核酸药物若想进一步扩大治疗领域,针对肝以外其他器官、组织的靶向递送技术仍需要进一步的研究开发。
(3)潜在免疫原性问题
小核酸药物不仅涉及核酸分子本身的免疫原性问题,还涉及到递送系统的免疫原性问题。目前对于核酸分子及其化学修饰的免疫原性控制已有深入了解,但LNP递送系统中复杂的成分以及所使用的各类配体分子均可能引入由免疫原性导致的安全性问题,平衡递送系统的有效性和安全性也是小核酸药物面临的一个挑战。
(4)药物价格昂贵
小核酸可实现自动化的化学合成和提纯,其药物分子本身的生产成本要远低于抗体类药物。但由于化学修饰和递送系统的研发以及工艺成本高昂,导致目前小核酸药物非常昂贵。例如,Nusinersen第一年的费用为75万美元,随后几年的费用为37.5万美元。
5.2
机理研究需跟工艺优化齐头并进
有效靶点的选择是小核酸药物开发的根本前提,基于靶标的序列设计是小核酸药物达到治疗效果、避免脱靶效应的关键,而任何靶点的选择都是建立在对于疾病致病机理深刻理解的基础上。目前,小核酸药物可针对的靶点仍然十分有限,核酸药物设计也在不断探索之中。小核酸药物具备一定的平台属性,一旦在递送系统方面取得突破,那么未来限制核酸药物行业拓展的主要因素将是如何寻找关键的靶点。
六、 总结与观点:具有化学修饰和药物递送核心技术平台的企业值得关注
小核酸药物独特的靶点和作用机制使其在“不可成药”或“不可靶向”疾病的治疗药物开发领域具有巨大的潜在价值。此外,与传统的小分子药物和抗体药物相比,小核酸药物在研发周期、药效持续性、临床开发成功率、特异性等方面也具有显著的差异化优势。在经历了四十余年的探索发现和曲折发展之后,随着核酸修饰和递送技术的突破,小核酸药物迎来了快速发展的黄金时期。此外,mRNA疫苗在疫情期间的优异表现也让小核酸药物成为医药行业和资本市场关注的焦点。未来几年,随着小核酸药物向肿瘤、遗传代谢疾病、罕见病等治疗领域不断拓展,行业市场也将进入快速增长阶段。但同时,现阶段小核酸药物行业的发展仍处于初级阶段。短期来看,化学修饰和递送系统仍将是限制小核酸药物开发的主要瓶颈,也是企业的核心竞争力所在。长期来看,靶点的发现和选择将是小核酸药物适应症拓展的关键,因此,对于疾病致病机理研究的同样至关重要。
投资方面,从生命周期来看,我国的小核酸药物行业尚处于导入期阶段,技术创新是现阶段这个行业最主要的驱动力。短期内,限制小核酸药物开发的最大技术障碍仍将是化学修饰和药物递送。目前,小核酸药物开发过程中所应用到的化学修饰位点、分子、化学反应多种多样,所使用的递送系统在组成、尺寸、结构、作用机制和最终效果上也各有差异。这种多样性反映了研究者们对于小核酸药物性质、作用机制及其在体内的转运代谢过程的研究不断深入,同时也意味着小核酸药物在递送领域尚有巨大的创新空间。由于无论是化学修饰还是递送系统都具有平台性,在这两方面具有技术优势的企业能基于技术平台快速开发出多样化的产品管线,建立竞争壁垒,从而更容易在这一赛道中脱颖而出。在潜在标的企业筛选过程中,核心研发人员经历以及产品管线的体外、临床前及临床数据的质量可在一定程度上反映技术平台的可验证性和研发的可持续性,理应是关注的重点。此外,小核酸药物的快速发展也将带动上游CDMO企业,拥有小核酸合成和提纯技术、核酸药物制剂稳定放大生产工艺的CDMO企业同样具备发展潜力。
附录:我国小核酸药物领域的初创企业
(1)艾博生物(mRNA)
苏州艾博生物成立于2019年 ,专注于mRNA疫苗研发,在分子设计、递送系统方面拥有核心技术,创始人曾就职于Moderna公司从事mRNA疫苗研发工作,具有多年资深从业经验和技术背景。2020年6月,艾博生物联合军事科学院军事医学研究院、沃森生物共同研制的新型冠状病毒mRNA疫苗进入临床I期研究阶段,成为中国首个进入临床阶段的mRNA 疫苗,并于2021年7月进入III期临床试验。同时,其与泰格医药合作的海外多中心III期临床试验也正在推进。除此之外,艾博生物也会在2021年推动针对 Beta、Delta 两个变异株的 mRNA 疫苗进入临床。艾博生物已于2021年7月初宣布建成中国首个符合GMP标准的mRNA疫苗生产基地,在mRNA疫苗领域具有先发优势。
(2)斯微生物(mRNA)
斯微生物成立于2016年,由美国MD Anderson肿瘤中心的博士团队归国创建。在核心技术方面,斯微生物拥有mRNA合成技术平台IVT-mRNA(体外转录mRNA),该平台已经可以稳定地合成各种长度和功能的mRNA,并建立了完整的质量控制体系。递送系统方面,斯微生物开发了LPP(lipopolyplex)纳米递送平台,LPP是一种以聚合物包载mRNA为内核、磷脂包裹为外壳的双层结构。与传统的LNP相比,LPP的双层纳米粒具有更好的包载和保护mRNA的效果,并对树突细胞展现出优异的特异性,在肿瘤疫苗开发领域具有较大潜力。公司的mRNA药物主要涵盖传染病和肿瘤两个领域。
(3)深信生物(mRNA)
深信生物成立于2019年,专注于预防性和治疗性mRNA疫苗及药物的开发。深信生物的核心竞争力在于其新一代LNP递送系统。公司的AI平台能够分析优化合成的LNP结构和活性数据,找到best-in-class的LNP结构。深信生物已构建了近5000个LNP库,可用于筛选适用于不同治疗场景的LNP载体,为后续mRNA产品管线的持续研发创造了极好的条件。凭借其领先的LNP递送技术平台,深信生物在传染病、罕见病、肿瘤治疗性疫苗、肿瘤免疫治疗增强剂等四大方向构建了研发管线。
(4)圣诺生物(siRNA)
苏州圣诺生物注册于2008年,是美国Sirnaomics公司在中国的研发与运营主体,创始人陆阳博士是最早投身RNAi领域的产学界专家之一。公司拥有多肽纳米颗粒 (PNP) 及新型GalNAc递送平台。PNP 递送平台有望通过局部或静脉给药,将siRNA及mRNA递送至除肝脏之外的靶器官患病细胞;而新型GalNAc递送平台能够实现对肝脏细胞高效、特定的siRNA药物递送。同时,两种递送平台还能够敲低两个不同的靶基因,以此产生协同效应。圣诺的管线适应症涵盖了癌症、纤维化疾病、代谢疾病和病毒感染等多种疾病,研究进度最快的核心候选产品STP705已进入II期临床阶段,用于治疗原位鳞状细胞癌和非黑色素瘤基底细胞癌。
(5)瑞博生物(ASO、siRNA)
瑞博生物成立于2007年,致力于小核酸药物研究和开发。公司开发出了核酸制药每个环节的关键技术,如siRNA候选序列的设计、活性筛选、核酸化学修饰、脱靶效应及免疫刺激反应评价、核酸化学以及生物分析方法、核酸制备工艺、中间体及药品质量研究、核酸给药技术及载体制备等,形成了较为完整的小核酸制药技术链和药物研发支撑体系。同时,还建立了包括核酸单体、原料药、药物递送载体和药物产品的工业生产能力。公司与跨国企业展开广泛合作,搭建了丰富的小核酸药物产品管线,适应症涵盖感染、肿瘤、代谢、心脑血管和神经等多个疾病领域,包括针对乙型肝炎、高血脂症等适应症的siRNA疗法。目前,公司已有4款产品处于临床研究阶段和临床试验申请阶段,有10余款产品处于临床前或早期发现阶段。
(6)中美瑞康(saRNA)
中美瑞康成立于2016 年,由RNA激活领域的开拓者李龙承教授创立,是国内少有的专注于saRNA药物开发的企业。中美瑞康建立了拥有独立自主知识产权的saRNA药物发现与开发平台,拥有10多个新药项目的研发管线,涵盖基因遗传病、肿瘤疾病、靶点在肝脏的代谢及血液系统疾病、皮肤疾病等领域。
(7)锐博生物(小核酸药物CDMO)
锐博生物拥有15年以上RNA合成与开发经验,专注于核酸药物(包括siRNA、反义核酸、miRNA、CRISPR及其它)的开发和生产,提供业界领先的一体化核酸药物CDMO/CMO服务,是国内第一家做寡核酸药物的CMO/CDMO公司,也是国内首个获得药品生产许可证的GMP寡核酸生产基地。公司目前拥有核酸药物生产、核酸分析检测平台、高通量测序、核酸新药研发等八大平台,提供包括RNAi、miRNA、lncRNA、细胞组织分析、生物芯片、高内涵筛选、生物信息学等十大类40多种产品及50多种服务。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



