机构:国泰君安
评级:增持
本报告导读:
公司公告抗 PD-1 单抗派安普利上市申请获药监局受理,申报适应症为复发或难治性经典型霍奇金淋巴瘤,公司产品线不断创新升级,维持增持评级。
摘要:
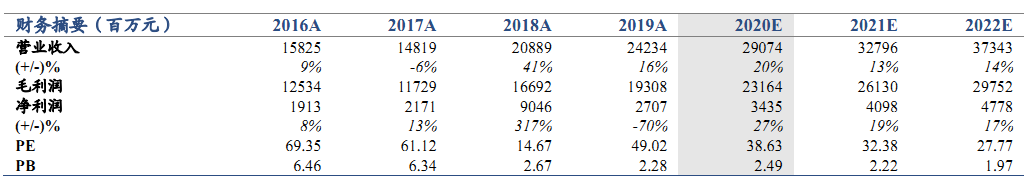
维持“增持”评级。公司2020 年5月26日发布公告,其与康方生物共同开发及商业化的抗PD-1单抗药物安尼可(通用名:派安普利,研发代号: AK105)的新药上市申请,已获中国国家药品监督管理局受理,用于治疗复发或难治性经典型霍奇金淋巴瘤患者。我们维持公司2020-2022年EPS预测值0.27/0.33/0.38元,考虑到公司大品种研发成果不断落地,产品线不断创新升级,上调目标价至13.80 港元(原为 12.13港元),维持增持评级。
派安普利可能是第5个上市的国产 PD-1抑制剂,有望借助公司强大销售网络快速放量。截止2020年5月,我国PD-(L)1产品已体现出进口和国产4+4的局面,从上市申报适应症来看,派安普利延续了国产 PD-1用小适应症快速获批上市的策略。国产和进口PD-1由于定价不同,抢占的是不同消费层级的患者,派安普利未来的上市,更多对现有的国产PD-1产品有冲击。我们预计卡瑞利珠单抗在 2019年上市5个月销量突破10亿,(对比信达和君实的 PD-1产品已在 2018年底获批,而2019年全年销售额分别为 10.2亿、 7.8亿),可以看出, PD-1的推广与企业医院终端覆盖面、销售体系等商业化综合能力休戚相关。未来派安普利上市,有望凭借公司 3000多人的肿瘤销售网络快速放量。
商业化策略逐渐清晰:以小适应症快速上市,大适应症的临床加快跟进。截止 2020 年 5 月 16 日,派安普利共有 13 项临床正在进行,其中 9项试验同时在中美进行了申报。目前已经进入三期阶段的有肺癌一线、胃癌二线和晚期肝细胞癌 3项患者基数较大的适应症,其中胃癌和肝癌的用药方式皆为派安普利与安罗替尼联用,“强强组合销售+大适应症策略”的发展态势已初见端倪。
催化剂:新产品及新适应症的研发进展,光脚品种的放量。
风险提示:带量采购的风险;新药研发的不确定性风险。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



