专注于抗肿瘤领域的基石药业-B(2616.HK)已经在港交所上市1年,近日公司公布首份年报成绩单。此前,格隆汇曾在公司发布2019半年报时发布公司业绩解读《PD-1/PD-L1赛道,基石药业(2616.HK)凭什么弯道超车?》,将公司的研发管线聚焦在备受瞩目的PD-(L)1赛道上。然而在公司发布2019年全年业绩上,格隆汇惊喜的发现,公司不仅在核心产品上开始进入新药申请的产品收获期,更在内部研发+外部合作双重驱动下,正在走向2.0版本的产品管线。
产品管线1.0:三大免疫肿瘤骨架药物资产
基石药业在研发管线设计之初,就是选取PD-1、PD-L1以及CTLA-4三个靶点作为核心骨架药物进行研发试验,并选取更加有效的联合治疗,使得药物效果发挥更大的作用。
目前,公司共计拥有15种抗肿瘤候选药物,包括3种处于临床阶段的肿瘤免疫治疗骨架候选药物(PD-L1、PD-1以及CTLA-4抗体),其中5种处于临床后期候选药物正在进行关键试验。
图表一:在研产品管线
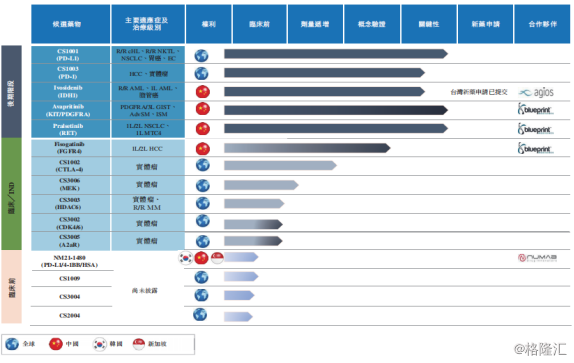
数据来源:公司公告,格隆汇整理
核心产品CS1001(PD-L1):最快2020年提交新药上市申请
随着PD-1产品开始纳入新医保目录,PD-1/PD-L1赛道的竞争也开始愈发激烈。目前国内尚未拥有国产PD-L1获批,根据Insight数据库显示,国内企业临床在研的PD-L1抗体共计有15个品种(涉及54个临床登记号),其中基石药业的CS1001(PD-L1)已有6个适应症进入临床III期。其中,进展最快包括经典型霍奇金淋巴瘤(cHL)及自然杀伤/T细胞淋巴瘤(NKTL),有望在2020年提交新药上市申请;而紧随期后的四期非小细胞肺癌(NSCLC)也取得了良好的临床进展,预计于2020年第三季度发布注册性试验关键数据。
那么在过去的一年中,有关CS1001(PD-L1)的研发进展如何?我们来看一组重磅临床数据。
以下是2019年基石药业在中国临床肿瘤学会CSCO、欧洲肿瘤内科学会ESMO和美国血液学会ASH三个重要会议上公布的有关CS1001(PD-L1)重要的临床数据情况:
(1)公司在2019年CSCO上公布CS1001(PD-L1)联合化疗针对食管癌的疗效和安全性(临床Ib期试验),客观缓释率(ORR)为77.8%,缓释持续时间(DCR)为88.9%;
(2)公司在2019年CSCO上公布CS1001(PD-L1)联合化疗针对胃/胃食管交界癌的疗效和安全性(临床Ib试验),客观缓释率(ORR)为62.1%,缓释持续时间(DCR)为82.8%;
(3)公司在2019年CSCO上公布CS1001(PD-L1)作为单药针对胆管癌/胆囊癌的疗效和安全性(临床Ib试验),客观缓释率(ORR)为10.3%,缓释持续时间(DCR)为37.9%;
(4)公司在2019年CSCO上公布CS1001(PD-L1)作为单药针对微卫星不稳定性高(MSI-H)/错配修复缺陷(dMMR)肿瘤的疗效和安全性(临床Ib试验),客观缓释率(ORR)为38.1%,缓解持续时间(DCR)为57.1%;
(5)公司在2019年ASH上公布CS1001(PD-L1)作为单药针对复发/难治性结外自然杀伤细胞/T细胞淋巴瘤(rr-ENKTL)的疗效(临床II期注册性试验)完全缓释率(CR)为31.8%,客观缓释率(ORR)为40.9%。
总体来看,目前公司正在进行CS1001(PD-L1)的总计6项注册性试验。其中,公司正在向国家药品评审中心(CDE)咨询cHL及NKTL的注册策略,预计于2020年下半年提交cHL适应症在中国大陆的新药申请,并可能于2020年下半年提交NKTL适应症在中国大陆的新药申请。
根据公开资料显示,中国PD-1/PD-L1的市场预测将达到50-100亿美元。其中,CS1001针对目前公布的适应症销售峰值将达到5亿美元,主要来自于大适应症非小细胞肺癌、胃癌以及食管癌。而公司的研发管线中,该产品在其他适应症的应用有望进一步提升产品的销售峰值。
CS1003(PD-1) 与CS1002(CTLA-4)其他两大骨干药物
CS1003是人源化的IgG4亚型的抗PD-1单抗,具有同时识别人和小鼠PD-1的独特优势。根据中国I期桥接临床数据显示(2019年CSCO年会中公布),CS1003(PD-1)单药具有良好的安全性和耐受性,且在多种肿瘤类型中均观察到了抗肿瘤活性。
目前,公司已启动多项联合治疗的临床试验研究,包括:2019年12月CS1003(PD-1)联合拜耳公司的乐伐替尼(lenvatinib)疗法的全球III期试验,乐伐替尼为用于晚期肝细胞癌(HCC)患者的标准酪氨酸激酶抑制剂(TKI);2019年12月在澳洲进行CS1003(PD-1)联合瑞戈非尼的临床Ib期试验实现首例患者给药等。
CS1002是全长全人源IgG1亚型的抗CTLA-4单抗,根据2019年CSCO公布的数据显示,CS1002(CTLA-4)治疗耐受性良好,有可能成为继Ipilimumab(中国未上市)之后,下一个疗效突出的CTLA-4抑制剂。CS1002(CTLA-4)在2019年12月完成临床I期首次患者给药,并在2020年1月在澳洲进行与CS1003(PD-1)联合治疗实体瘤换成的临床I期试验剂量递增部分中实现首例患者给药,使得公司在这一联合治疗方案中处于领先地位。
产品管线2.0:更加先进的产品组合
作为国内唯一一家同时拥有临床阶段PD-1、PD-L1以及CTLA-4产品的公司,基石药业并不满足于停留在三大靶点上,而是不断探索寻找,是否存在下一个类似于PD-1/PD-L1这样市场空间大、治疗疗效好的产品,这也就是基石药业研发创新的新方向,也就是2.0产品管线的核心思想。
如何打造更加先进的产品组合?按照公司披露的计划,公司将在原有的免疫肿瘤骨干药物和资产的基础上,寻找同类首创或者同类最优的多重特异性单抗/分子骨架,或者最大化PD-(L)1疗效的肿瘤微环境调节剂,未来也有可能寻找癌症疫苗,或者新的通路抑制剂。
具体操作上,对外引进优质资产,与国内外领先的生物医药公司合作,获得独家开发和商业化权益,对内展开重点临床开发,以肿瘤免疫联合疗法作为重点临床合作项目。
TIBSOVO®(Ivosidenib):同类首创,在美国获批上市,已在中国台湾提交新药申请
TIBSOVO®(ivosidenib)是全球同类首创IDH1抑制剂,已经获得美国FDA批准治疗伴有IDH1突变的急性髓系白血病(IDH1m AML)。基石药业已在2018年6月获得Agios独家许可,可以在中国地区(包括港澳台)对TIBSOVO®(Ivosidenib)进行临床开发及商业化开发。
2019年5月, TIBSOVO®(ivosidenib)的新药申请已提交台湾食品药物管理署(TFDA),用于治疗含有IDH1突变的复发难治性急性髓系白血病(IDH1m R/R AML),预计将于2020年获得市场批准。IDH1m AML的两项注册性试验正在中国进行:一项IDH1m R/R AML的注册性试验预计于2020年完成试验,并于2021年上半年在中国提交新药申请;另一项试验针对不符合强化治疗条件的新诊断的IDH1m AML患者。
AYVAKITTM(avapritinib):同类首创, 在美国获批上市,已向中国台湾提交新药申请
Blueprint 研发的AYVAKITTM(avapritinib)是全球同类首创PDGFRA/KIT抑制剂,首个获得美国FDA批准的胃肠道间质瘤(GIST)精准疗法,也是PDGFRA外显子18突变体(包括D842V突变)GIST的唯一高活性疗法。
基石药业作为拥有AYVAKITTM(avapritinib)在中国地区(包括港澳台)独家开发及商业化许可的公司,目前已经在台湾针对用于治疗PDGFRA外显子18 突变(包括PDGFRAD842V突变)不可切除或转移性GIST适应症提交新药申请。
此外,公司在中国针对无法切除或转移性GIST的患者已启动AYVAKITTM(avapritinib)的两项注册性试验。一项试验是中国药代动力学桥接研究,用于治疗PDGFRA外显子18 突变的晚期GIST,预计于2020年上半年将在中国提交新药申请。另一项试验在三线GIST中进行,作为一项比较AYVAKITTM(avapritinib)和瑞戈非尼全球III期试验的一部分。该研究已经完成招募,预计于2020年第二季度将获得全球临床试验关键数据,并于2020年下半年于中国提交新药申请。
Pralsetinib(RET):潜在同类首创,已启动美国FDA新药上市滚动申请
Pralsetinib是首个针对RET突变非小细胞肺癌的潜在同类首创RET抑制剂,目前已经启动美国FDA新药上市滚动申请。
作为拥有pralsetinib中国地区(包括港澳台)独家开发及商业化许可的公司,基石研究pralsetinib 用于治疗RET突变的NSCLC、甲状腺髓样癌(MTC)和其他晚期实体瘤。目前已经完成了在中国的RET融合阳性NSCLC适应症二线治疗队列研究的招募,并预期于2020年下半年在中国针对此适应症提交新药申请。此外,基石已启动一线RET融合阳性NSCLC的其他注册队列,预计于2020年上半年实现首例受试者给药。
强化基石肿瘤管线,赋能联合疗法开发
今年,基石药业新增了与两家知名药企的合作。2019年6月,基石药业与拜耳达成以中国为重点的全球临床合作关系,评估PD-L1药物CS1001联合拜耳的口服多激酶抑制剂瑞戈非尼在治疗包括胃癌在内的多种癌症时的安全性,耐受性,药代动力学特征以及抗肿瘤活性等在内关键数据,这也是双方合作开展的首个全球概念验证性研究。
此外,2019年5月基石药业与瑞士Numab Therapeutics AG达成区域性独家协议,主要针对NM21-1480的开发和商业化。NM21-1480是一种针对PD-L1,4-1BB和人血清蛋白的单价三特异性抗体片段分子。此次基石药业获得NM21-1480的开发和商业化,不仅能够在未来商业化中,获得大中华区,韩国以及新加坡独家开发和商业化NM21-1480的权利,还能够间接获得Numab独创的多特异性抗体技术平台的使用。
2020年:商业化加速,产品进入收获期
2019年,公司在研发产品上获得了多项重大进展。截至目前,已有两款新药在台湾提交上市申请。2020年,公司预计一款新药上市申请获批,另有多款新药计划提交上市申请。由此,公司商业化进程正积极推进,并将为公司提供可预见的现金流。
具体来看,公司将会有TIBSOVO®(Ivosidenib)在中国台湾提交新药上市申请预计在2020年获得批准并上市。此外,公司预计2020年将会有CS1001(PD-L1)、AYVAKITTM(avapritinib)、pralsetinib(RET)三款药物提交新药上市申请,临床试验共计拥有30项,其中包括15项注册性试验。
图表四:2020年重大事件计划表
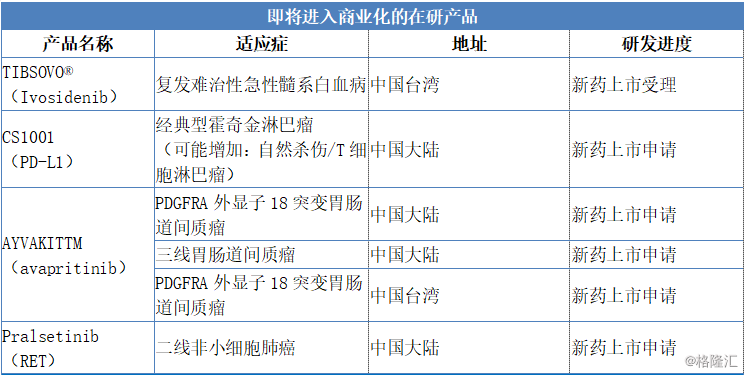
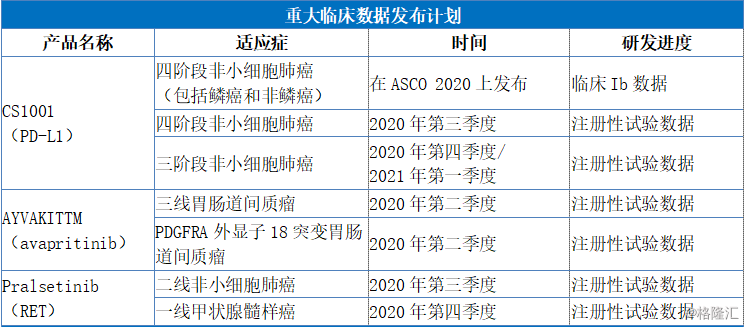

数据来源:公司公告,格隆汇整理
为了配合接下来一系列产品的商业化,公司聘请了前BMS中国大陆及香港地区总经理赵萍女士担任大中华区总经理及公司商业化负责人,并计划在2020年底前将商业化团队规模扩大至200人,并在2021年前进一步提升至400人。
与此同时,公司为生物制剂及小分子配备强大的生产能力,目前已与新建元(苏州工业园区所属企业)签订协议建设生产基地,规划总计容面积近100,000㎡,预计产能达到26,000L大分子生物药和10亿片小分子化学药片剂和胶囊。该基地预计将于2020年上半年动工兴建。
小结
2019年初,基石药业成功在港交所上市。而仅仅一年左右的时间,公司就有两款创新药提交新药申请,意味着公司正在加速向商业化进程推进转型。这一进程也获得了资本市场的积极关注。目前,公司取得了5家顶级金融机构的推荐,包括高盛、摩根士丹利、摩根大通、瑞银与招商证券(香港)。
正如产品需要更新换代来跟上时代的发展,观察公司的发展路径可以发现,公司也在通过升级产品管线来丰富与应对日益扩大的肿瘤市场。更加强大的产品管线2.0,配合不断升级完善的商业化能力,变身成为“现金牛”指日可待。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员



