格隆汇获悉,10月30日,辽宁成大生物股份有限公司(下文简称“成大生物”或“公司”)向联交所主板提交上市申请资料,中信里昂和广发融资香港作为联席保荐人。
2014年12月,成大生物(831550.NEEQ)的内资股开始在新三板挂牌交易,经过2016年7月的定向增发,注册资本增至人民币3.748亿元。截至最后可行日期,控股股东辽宁成大(600739.SH)持有约2.27亿股内资股,约占公司股本权益的60.54%。
成大生物是一家生物科技公司,在中国人用疫苗市场处于领先地位。根据弗若斯特沙利文的资料,2017年,按净利及收入计,成大生物在中国人用疫苗公司(其财务信息可供公众查询)中分别排名第二和第三。核心产品目前包括人用狂犬病疫苗及灭活乙脑疫苗,根据弗若斯特沙利文的资料,按批签发批准的数量计,人用狂犬病疫苗自2008年于中国出售的所有人用狂犬病疫苗产品中销量第一,而灭活乙脑疫苗为目前中国唯一出售的灭活乙脑疫苗。
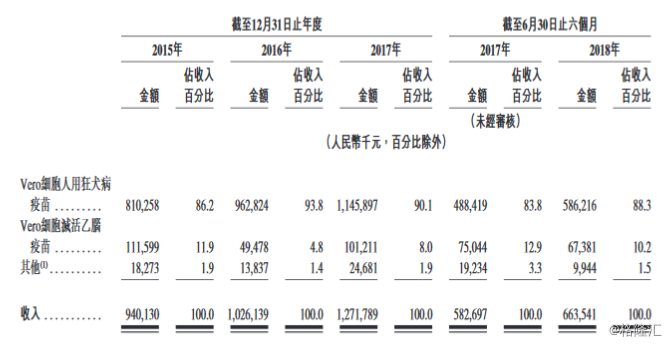
公司几乎全部的收入来自于销售疫苗产品,包括Vero细胞人用狂犬病疫苗及Vero细胞灭活乙脑疫苗。2015年-2017年及2018年上半年,来自Vero细胞人用狂犬病疫苗的收入分别为人民币约8.10亿元、9.63亿元、11.46亿元、5.86亿元,分别占总收入的86.2%、93.8%、90.1%、88.3%;来自Vero细胞灭活乙脑疫苗收入分别为人民币约1.12亿元、4947.8万元、1.01亿元、6738.1万元,分别占总收入的11.9%、4.8%、8.0%、10.2%。
成大生物开发核心产品技术、生物反应器高密度悬浮培养技术及层析纯化工艺,显著提高不同批次产品质量的稳定性以及批量生产的效率。公司在北京及沈阳有两处研发中心以开发超过九个产品(包括计划2020年获得NDA批准的出血热疫苗)组成的多元化产品管线。
人用狂犬病疫苗:按批签发批准的数量计,成大生物的人用狂犬病疫苗自2008年起已占据国内市场领先地位,按收入计,占2017年35.7%的市场份额。自推出以来,已合计共售出超过7000万人份的人用狂犬病疫苗。公司的人用狂犬病疫苗是目前中国唯一在售的能够采用Zagreb 2-1-1注射法的狂犬病疫苗。往绩记录期间,公司的人用狂犬病疫苗销往中国所有省份、直辖市和自治区,包括1697家区县级疾控中心。自2008年以来,我们的每批人用狂犬病疫苗产品均获得中检院的批签发合格证,达到100%的合格率。
灭活乙脑疫苗:根据弗若斯特沙利文的资料,成大生物的乙脑疫苗是一种可注射的Vero细胞灭活乙脑疫苗,六个月大的婴儿至10岁的儿童均可接种,进入乙脑疫区的其他大龄儿童成人亦可接种,以预防乙型脑炎。公司的乙脑疫苗自2008年上市,目前为中国市场上唯一在售的灭活乙脑疫苗。它具有强大的免疫保护作用,其在中国第三阶段临床试验结果中的抗体阳转率平均高达90.0%以上,高于中国生产的其他乙脑疫苗。往绩记录期间,公司的乙脑疫苗销往中国28个省份、直辖市及自治区,包括557个区县级疾控中心。2012年采用乙脑疫苗新质量标准后,公司的每批灭活乙脑疫苗产品均获得中检院的批签发合格证,达到100%的合格率。
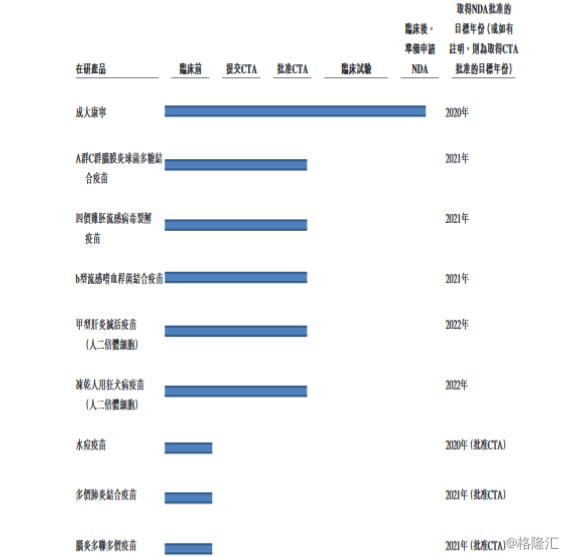
产品管线:成大生物拥有超过九种产品组成的强有力产品管线。公司的可注射出血热疫苗产品成大康宁已处于临床后评估阶段,并筹备申请NDA,计划2020年获得NDA批准。公司亦有五种管线产品已获准开始临床试验,以及三种管线产品正处于临床前研究阶段。
质量管理及认证:成大生物已实施符合国际标准、全国性法规及行业指引的质量管理体系,并采用标准操作程序。公司按照中国国家食药监局采用的GMP规范以及PIC/S采纳的一套国际GMP规范,来设计和维护其所有的生产设施。自2005年以来,通过了中国监管机构的22次GMP检查以及美国及泰国等境外监管机构的12次GMP检查。具体而言,往绩记录期间,公司通过了国家食药监局或其地方机构所进行的八次GMP检查,包括最近于2018年7月及8月进行的检查,全部八项检查中并无发现任何重大缺陷或不合规事项。
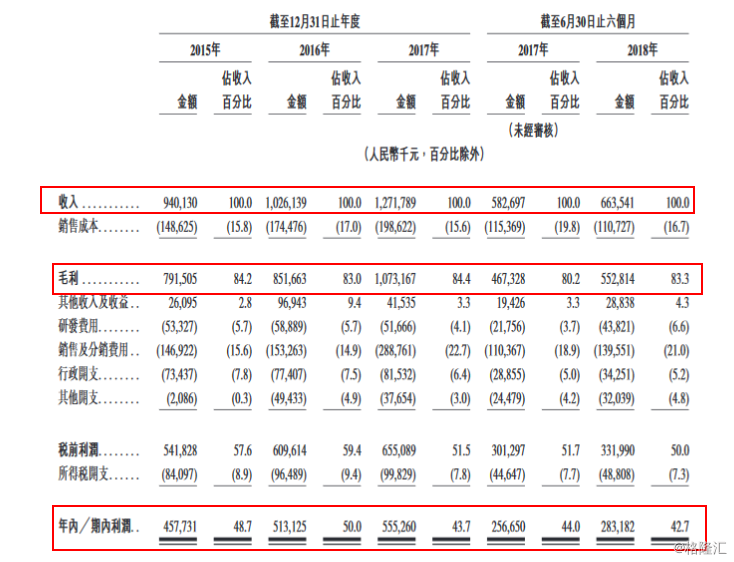
往期业绩方面,2015年-2017年及2018年上半年,成大生物实现收入分别约人民币9.40亿元、10.26亿元、12.72亿元、6.64亿元,年复合增长率达16.3%;毛利分别约人民币7.92亿元、8.52亿元、10.73亿元、5.53亿元;毛利率分别为84.2%、83.0%、84.4%、83.3%。
相应期间,净利润分别约人民币4.58亿元、5.13亿元、5.55亿元、2.83亿元,年复合增长率达10.1%;净利润率分别为48.7%、50.0%、43.7%、42.7%。
公司拟将融资净额用于以下用途:一是,用于为各资本支出项目提供资金,以提高及升级产能,包括建设用于生产管线产品的新设施,以及升级用于生产现有产品的现有设施(视乎适用监管批准及备案而定)。具体而言如下:
(1)为在辽宁省本溪市继续建设用于生产管线产品(如人二倍体细胞甲型肝炎灭活疫苗、四价鸡胚流感病毒裂解疫苗、A群C群脑膜炎球菌多糖结合疫苗及B型流感嗜血杆菌结合疫苗)的新生产设施及配套设施提供资金。公司在用于生产兽用狂犬病疫苗的现有建筑及厂房基础上建设该等新生产设施,并已于2018年10月开始建设,预期18个月内竣工;
(2)为在辽宁沈阳建设用于生产人用疫苗(如人二倍体细胞人用狂犬病疫苗、肺炎疫苗及水痘疫苗)的新生产设施提供资金,并将于2019年第四季度开工;
(3)为升级辽宁沈阳的现有生产设施提供资金,公司计划借此提高生产流程的自动化程度、安装更先进的设备及提高我们的人用狂犬疫苗和乙脑疫苗的产能,我们预计投入约[编纂]百万港元并将於2019年第四季度开始改造。
二是,用于加强研发能力。具体如下:(1)为公司现有管线产品研发项目(包括临床试验)提供资金及进一步丰富我们的产品管线;(2)为扩建公司位于中国北京的研发中心提供资金,并已于2018年第二季度开工。
三是,用于为战略交易(如有意收购拥有疫苗产品或技术的国内外公司或与其合作,该等公司可丰富公司现有的产品组合、提升技术或提高业务增长或拥有该等技术的许可)提供资金。截至最后可行日期,公司未发现任何特定收购目标。
余下用于一般企业用途。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员