7月初,复星国际,复星医药联合发布建议分拆复宏汉霖于香港联交所主板独立上市,8月25日其刊发的更新申请版本已过聆讯,随着复宏汉霖核心产品HLX01汉利康®(利妥昔单抗注射液)获批上市,成为国内首个获批的生物类似药,复宏汉霖此次赴港上市,颇受外界关注。
一.国内生物类似药迎来“黄金年代”
从1986年第一个治疗性单克隆抗体药物上市以来,生物制药已经逐渐成为全球医药市场重要的组成部分。
根据各大医药公司公告披露数据统计显示,2018年全球最畅销的10款药品中,8款为生物药,其中6款为单抗品种,合计销售额681.01亿美元,占TOP10中的77.69%。其中以Humira®(阿达木单抗)销售额最高,单只药品全年销售额达到199.36亿美元。
在原研药的蓬勃发展的趋势下,药品价格高、专利保护期等问题愈发凸显,为患者带来较重的用药负担。近年来,随着各大重磅品种专利保护期邻近,许多生物制药企业抓住机遇,着手于生物类似药的开发,力求在疗效、安全性相似的前提下,大幅度降低用药成本,使得更多患者能够得到有效治疗。
根据EMA、FDA数据统计显示,2017年至2018年期间欧盟和美国新批准的生物类似药数量分别为此前批准总数的1.4倍和3倍,其中,EMA在2018年批准的生物类似药多达16款。
根据弗若斯特沙利文报告显示,2014年至2018年期间中国生物类似药市场规模在20亿元内,而随着原研药专利保护到期,国内生物类似药已迎来“黄金时代”。预计2019年至2023年复合年增长率可达74.2%,2023年生物类似药市场规模可达259亿人民币。
图表一:中国生物类似药市场规模及预测(2014-2023E)
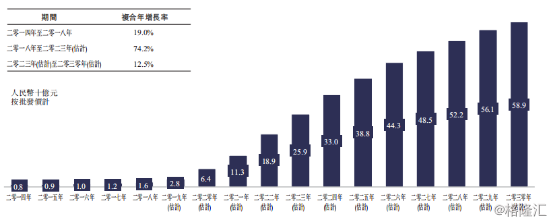
数据来源:公司公告,格隆汇整理
二.丰富的管线+领先的进度,缔造行业先发优势
从进度上而言,复宏汉霖的产品管线,走在绝大部分生物药企的前列,获得先发优势。
从最新一版的招股说明书公布的产品管线中可以看出,复宏汉霖除已商业化及近期可商业化的生物类似药产品HLX01汉利康®(利妥昔单抗注射液)、HLX02(注射用曲妥珠单抗)、HLX03(阿达木单抗注射液)、HLX04(贝伐珠单抗生物类似药)外,还有20种以上候选创新生物药及肿瘤免疫联合疗法。其中1个产品获得欧盟上市申请受理,2个产品获得中国新药上市申请受理,14个产品、6个联合治疗方案在全球范围内开展20多项临床试验。HLX02不仅在中国大陆、乌克兰、欧盟波兰和菲律宾全面启动国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,并于2019年4月和6月分别获中国药品监督管理局和欧洲药品管理局上市申请受理。
图表二:产品管线


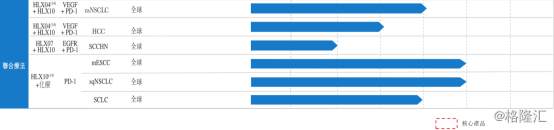
数据来源:公司公告,格隆汇整理
HLX01汉利康®:国内首款获批上市生物类似药,纳入国家医保
汉利康®(利妥昔单抗注射液),通用名为重组人鼠嵌合抗CD20单克隆抗体注射液。复宏汉霖于2012年5月就该产品递交临床试验申请,2017年10月提交上市申请。2019年2月22日,汉利康®正式获国家药监局批准用于非霍奇金淋巴瘤的治疗,成为国内首个获批上市的生物类似药,2019年5月正式进入国内市场。
原研利妥昔单抗最初于1997年获FDA批准,1998年获EMA批准,用于非霍奇淋巴瘤的治疗。虽然原研药在大部分地区已到专利保护期(欧洲于2013年到期、美国于2016年到期),但药品销量仍保持高位。根据罗氏数据显示,2018年由其分销的原研药在中国销售额达到25亿元。
在弗若斯特沙利文发布的数据“按原研药及生物类似药划分中国利妥昔单抗市场”中,生物类似药尚未出现时,市场被原研药占据,而随着生物类似药的进入,生物类似药的市场规模占比逐步增长,从2019~2023年,生物类似药市场规模预计达27亿元,占总规模的39.7%,并在未来数年后占比超过50%以上。
图表三:按原研药及生物类似药划分中国利妥昔单抗市场(2014-2030E)
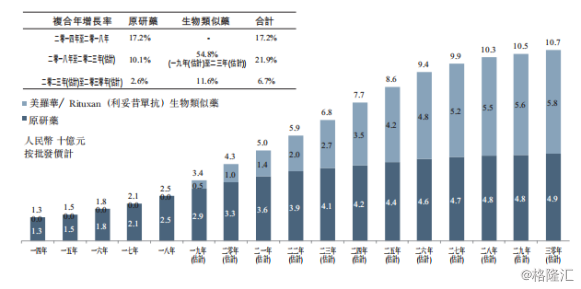
数据来源:公司公告,格隆汇整理
HLX02(注射用曲妥珠单抗): 中国、欧盟上市申请获受理
HLX02(注射用曲妥珠单抗),通用名为注射用重组抗人表皮生长因子受体2人源化单克隆抗体,主要用于HER2阳性早期乳腺癌及转移性乳腺癌、转移性胃癌的治疗。
HER2是晚期胃癌和晚期乳腺癌治疗的重要靶点,曲妥珠单抗是当前全球销量最大的抗HER2单抗药。乳腺癌、胃癌细胞的HER2异常扩增或过表达,可导致肿瘤细胞内信号通路的异常活化,与肿瘤发生发展和侵袭转移有关。曲妥珠单抗被广泛视为HER2阳性乳腺癌一线治疗的标准治疗,也是唯一被批准用于胃癌和胃食管结合部腺癌治疗的HER2单抗药。根据弗若斯沙利文数据显示,2018年原研曲妥珠单抗销售额达到69亿瑞士法郎,约500亿人民币,而曲妥珠单抗在中国销售额为32亿元人民币。
2019年4月,注射用曲妥珠单抗HLX02获得国家药监局新药上市申请受理,成为首个按照生物类似药指导原则开发的曲妥珠单抗。2019年6月,HLX02向EMA提交上市申请并获得正式受理,是首个在欧盟报产的国产单抗生物类似药,也是首个被欧盟受理的“中国籍“曲妥珠单抗。
HLX03(阿达木单抗注射液)与HLX04(贝伐珠单抗生物类似药): 3期临床试验
目前,HLX03以及HLX04均已经完成/进入3期临床试验。其中,HLX03为阿达木单抗的生物类似药,主要用于类风湿性关节炎、强直性脊柱炎、斑块状银屑病的治疗,且已于2019年1月获得国家药监局新药上市申请受理,随后被纳入优先审评程序。
HLX04为贝伐珠单抗生物类似药,主要用于转移性结直肠癌以及非鳞状非小细胞肺癌的治疗,目前已在国内开展转移性结直肠癌适应症的3期临床试验,预计2020年就转移性结直肠癌及非鳞状非小细胞肺癌向国家药监局提交新药上市申请。
仿创结合,搭建高效自主的生物医药产业平台
在耕耘生物类似药的同时,复宏汉霖也在创新药上逐步在发力。根据公司公告显示,目前拥有的生物创新药包括HLX06(抗VEGFR2单抗)、HLX07(抗EGFR单抗)、HLX10(抗PD-1单抗)、HLX20(抗PD-L1单抗)以及HLX22(抗HER2单抗)等皆在全球范围启动1期/2期临床试验,HLX55(抗c-MET单抗)也已获得临床试验申请受理。
未来,复宏汉霖将充分利用自有的多元化的、领先的产品管线,积极打造多元化的基于自有产品(以抗PD-1、PD-L1抗体等为核心)的联合疗法组合,把握未来肿瘤免疫机遇,提供可负担的、疗效更好的治疗方案。
综合来看,作为中国研发单抗药物的领导者,复宏汉霖在抗体药物的研发、生产、质量、药政与临床、商业化方面表现出色,已搭建高效自主的一体化产业平台。
在研发上,公司专注于肿瘤以及自身免疫性疾病领域,仿创药物相结合,已在中国上海、中国台北以及美国加州均设有研发实验室,三个研发中心密切合作,以确保高产并具有成本效益的研发过程。由于公司在抗体研发的各个阶段都积累了丰富的经验及专业知识,使得能够在多个司法管辖区域内有效地开展抗体产品的研发,涵盖候选药物培育到后期GMP生产。
在生产上,公司已在上海徐汇建成产能14000L的生物药产业化基地,包括6台2000升一次性生物反应器以及4台500升一次性生物反应器,目前正在建设位于上海松江的第二座生产基地,从而支持全球化商业需求。值得注意的是,作为中国首个生物类似药上市的核心产品汉利康,已经建立清晰的中国商业化策略,包括将利用复星医药的市场准入能力,全国性的销售以及市场网络快速大规模商业化,并在阿根廷,巴拉圭,乌拉圭以及玻利维亚地区与Biosidus签订了有关商业化的授权许可协议。
三.研发投入增幅加大
在此次更新的招股书中,复宏汉霖也更新了2018年的财务数据。作为一家研发导向型的生物制药企业,研发投入将对产品进度产生重要影响。
2016年至2018年间,复宏汉霖在研发投入上逐年递增。2016年研发投入8847万,2017年研发投入2.57亿元,增幅达190%, 2018年投入增长增速放缓至3.65亿元,但也有42.13%的同期增长速度。2019年1月至3月31日,研发费用超过1亿元,同期增长103.5%。
而在收入上,2017年复宏汉霖录得3391万元,2018年收益742.1万元,2019年1月至3月31日录得92.4万元。随着复宏汉霖首个产品汉利康®步入商业化销售阶段,未来可能面临数十亿的市场规模,最新财报数据值得持续关注。
图表四:复宏汉霖研发费用
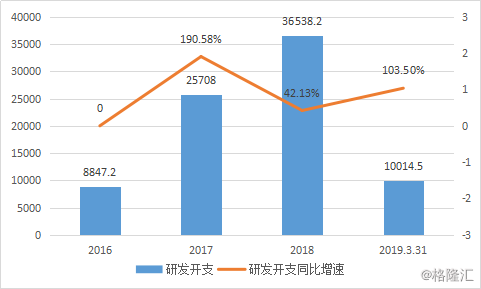
数据来源:公告公告,格隆汇整理 单位:万元人民币
四.小结
复宏汉霖作为一家中国领先的生物制药公司,拥有多元化的、领先的产品发管线。2019年初,国内首个生物类似药汉利康®(利妥昔单抗注射液)成功获批,公司其他产品也增快了研发步伐。以优质生物药,造福全球病患。这一步,复宏汉霖走在了行业前列。
 下载格隆汇APP
下载格隆汇APP
 下载诊股宝App
下载诊股宝App
 下载汇路演APP
下载汇路演APP

 社区
社区
 会员
会员